
Leitlinie für die Behandlung von CRPS (2018)
10. September 2018 – Die S1-Leitlinie „Diagnostik und Therapie komplexer regionaler Schmerzsyndrome (CRPS)“ (AWMF-Registernummer 030/116) steht in einer umfänglich überarbeiteten Neufassung zur Verfügung. Prof. Dr. Frank Birklein, Mainz, hat die Leitlinienarbeit koordiniert.
Die rund 50 Seiten umfassende Leitlinie gibt dezidierte Empfehlungen zur Diagnosestellung und Therapie komplexer regionaler Schmerzsymptome (CPRS), auch mit dem Ziel, die Chronifizierung fördernde Faktoren wie schmerzhafte invasive Therapieverfahren zu vermeiden und psychische Komorbiditäten rechtzeitig zu erkennen.
Ein CRPS entwickelt sich in ca. 2% der Fälle nach einem Trauma im Bereich der distalen Extremitätenabschnitte. Dabei hält sich die Symptomatik nicht an Nerveninnervationsterritorien. Nur extrem selten kommt es im Verlauf zum Ausbreiten der Symptomatik auf andere Extremitäten. Eine hohe Schmerzintensität noch 1 Woche z.B. nach konservativ behandelter Radiusfraktur kann ein erster Indikator dafür sein, dass sich ein CRPS entwickeln kann.
Diagnose
Die Diagnosestellung erfolgt nach definierten klinischen Kriterien, sofern Erkrankungen, die ein CRPS imitieren können, ausgeschlossen wurden. Das Vorhandensein einer Druckschmerzhyperalgesie der Gelenke distal einer Fraktur/Operationsstelle hilft, die klinische Diagnose CRPS zu sichern. Apparative Untersuchungen können zur Bestätigung der klinischen Diagnose insbesondere bei zweifelhaften Fällen hinzugezogen werden. Sie sind aber aufgrund mittlerer Sensitivität (ca. 75 Prozent) nicht geeignet, ein CRPS auszuschließen.
Alle CRPS-Patienten sollten auf das Vorliegen posttraumatischer Belastungssymptome und genereller Angstsymptome hin untersucht werden. Letztere haben einen negativen prädiktiven Wert für den Therapieverlauf.
Therapie: Spinalganglien-Stimulation an der LWS könnte Alternative zur SCS sein
In akuten Stadien ist eine entzündungshemmende Therapie mit Steroiden (z.B. Beginn mit 100 mg Prednisolon, über 2 Wochen abdosieren) indiziert. Bisphosphonate (unterschiedliche Dosierungen je nach Substanz) können Schmerz und Hyperalgesie reduzieren und die Lebensqualität bei CRPS mit einer Dauer von weniger als sechs Monaten verbessern. Ketamin-Infusionen über mehrere Tage reduzieren die Schmerzen und verbessern, allerdings nur in geringem Umfang, die Funktion bei CRPS über einen Zeitraum von mehreren Wochen. Grundsätzlich besteht bei Ketamin ein erhöhtes Risiko unerwünschter psychotroper Effekte, von Abhängigkeit sowie bei wiederholter Anwendung von Organschäden.
Eine kombinierte Physio – Psychotherapie, die den Zusammenhang zwischen Schmerz, Ängste und Vermeidung identifiziert und gezielt therapiert („graded exposure“), ist bei CRPS wirksamer als Standardphysiotherapie. Die „Pain Exposure Physiotherapie“ (PEPT) verbessert die Funktion, aber nicht die Schmerzen bei CRPS und wird nicht mehr empfohlen. Für regionalanästhetische Verfahren am Sympathikus gibt es nach wie vor keine Evidenz zur Wirksamkeit. Die Spinalganglien-Stimulation an der LWS könnte eine Alternative zur wirksamen rückenmarksnahen Elektrostimulation (SCS) sein.
Wenn keine komplizierenden Faktoren dazukommen und eine adäquate Therapie rechtzeitig eingeleitet wird, ist die Prognose eines CRPS nicht zwangsläufig schlecht. Mit einem Jahr dauernden relevanten Schmerzen vor allem bei Belastung muss in den meisten Fällen gerechnet werden, oft auch länger. Wichtig ist die Abgrenzung von Traumafolgen, die nicht durch das CRPS selbst bedingt sind, aber von Patienten damit in Verbindung gebracht werden wie Knochenmarködeme, Arthrosen, myofasziale Beschwerden und Veränderungen proximaler Gelenke aufgrund der CRPS-assoziierten Schonhaltung.
Bewertungsblatt für die Diagnose/Behandlung von CRPS
“Clinical Pathways“

Bewertungsblatt herunterladen
PDF-Dokument [218.0 KB]
Leitlinien für Diagnostik und Therapie in der Neurologie
Diese Leitlinien sind letztmals im September 2012 in der 5. Auflage in Buchform erschienen und werden seitdem laufend auf dieser Website aktualisiert. Aufgrund der langen Aktualisierungszyklen bei gedruckten Werken werden die Leitlinien der DGN seitdem ausschließlich online publiziert: auf dieser Website und kurz darauf bei der Arbeitsgemeinschaft wissenschaftlich-medizinischer Fachgesellschaften AWMF. Leitlinien sind im Einzelfall bis zu 5 Jahre lang gültig und die komplexen Abwägungskongresse mit dutzenden Experten sowie verschiedenen Fachgesellschaften dauern bisweilen Monate oder Jahre. Die rund 900 ehrenamtlich tätigen Autoren und die Redaktion bemühen sich, die Aktualisierungen so schnell wie möglich auf dieser Website zu publizieren. Auf diese Weise kommen neue wissenschaftliche Erkenntnisse schneller den Ärzten und schließlich den Patienten zugute. Kontakt zur Redaktion: leitlinien@dgn.org

Leitlinie herunterladen
PDF-Dokument [690.0 KB]

Link zur Webseite der Deutschen Gesellschaft für Neurologie
Leitlinie in ausführlicher Form
AWMF-Registernummer: 030/116
Leitlinien für Diagnostik und Therapie in der Neurologie
Diagnostik und Therapie komplexer regionaler Schmerzsyndrome (CRPS)
Entwicklungsstufe: S1
Federführend: Prof. Dr. Frank Birklein, Mainz
Herausgegeben von der Kommission Leitlinien der Deutschen Gesellschaft für Neurologie
Leitlinien für Diagnostik und Therapie in der Neurologie © DGN 2018
Version vollständig überarbeitet: 8. Januar 2018
gültig bis: 7. Januar 2023
Kapitel: Kopfschmerzen und andere Schmerzen
Zitierhinweis: Birklein F. et al., Diagnostik und Therapie komplexer regionaler Schmerzsyndrome (CRPS), S1-Leitlinie, 2018; in: Deutsche Gesellschaft für Neurologie (Hrsg.), Leitlinien für Diagnostik und Therapie in der Neurologie.
Korrespondenz: frank.birklein@unimedizin-mainz.de
Im Internet: www.dgn.org | www.awmf.de
Was gibt es Neues?
Wenn die Schmerzen nach einer konservativ behandelten distalen Radiusfraktur nach 1 Woche immer noch >/= 5 auf einer Rating-Skala bis 10 sind, dann steigt das Risiko für ein CRPS an.
Das Vorhandensein einer Druckschmerzhyperalgesie der Gelenke distal einer Fraktur/Operationsstelle hilft, die klinische Diagnose CRPS zu sichern.
Alle CRPS-Patienten sollten auf das Vorliegen posttraumatischer Belastungssymptome und genereller Angstsymptome hin untersucht werden. Letztere haben einen negativen prädiktiven Wert für den Therapieverlauf.
Neridronat 400 mg i.v. kann Schmerz und Hyperalgesie reduzieren und die Lebensqualität bei CRPS < 6 Monate Dauer verbessern.
Ketamin-Infusionen über mehrere Tage reduzieren die Schmerzen und verbessern, allerdings nur in geringem Umfang, die Funktion bei CRPS über einen Zeitraum von mehreren Wochen. Grundsätzlich besteht bei Ketamin ein erhöhtes Risiko unerwünschter psychotroper Effekte, von Abhängigkeit sowie bei wiederholter Anwendung von Organschäden.
Niedrig dosierte intravenöse Immunglobuline (0,5 g/kg) sind bei chronischem CRPS nicht wirksam.
Physiotherapie, die konkrete Ängste gezielt reduziert („graded exposure“), ist bei CRPS wirksamer als Standardphysiotherapie.
Die „Pain Exposure Physiotherapie“ PEPT verbessert die Funktion, aber nicht die Schmerzen bei CRPS und wird nicht mehr empfohlen.
Für regionalanästhetische Verfahren am Sympathikus gibt es nach wie vor keine Evidenz zur Wirksamkeit.
Die Spinalganglien-Stimulation an der LWS könnte eine Alternative zur rückenmarksnahen Elektrostimulation (SCS) sein.
Die wichtigsten Empfehlungen auf einen Blick
Ein CRPS entwickelt sich nach einem Trauma im Bereich der distalen Extremitätenabschnitte. Dabei hält sich die Symptomatik nicht an Innervationsterritorien. Nur extrem selten kommt es im Verlauf zum Ausbreiten der Symptomatik auf andere Extremitäten. Eine Schmerzstärke von ≥ 5 noch 1 Woche nach distaler Radiusfraktur kann ein Indikator für ein sich entwickelndes CRPS sein.
Die Diagnosestellung erfolgt nach definierten klinischen Kriterien, sofern Erkrankungen, die ein CRPS imitieren können, ausgeschlossen wurden. Apparative Untersuchungen (Knochenszintigraphie, Temperaturmessung, Bestimmung einer Druckschmerzhyperalgesie über distalen Gelenken und nach Replikation der ersten Ergebnisse auch die Messung von Osteoprotegerin) können zur Bestätigung der klinischen Diagnose insbesondere bei zweifelhaften Fällen hinzugezogen werden. Sie sind aber aufgrund mittlerer Sensitivität (ca. 75%) nicht geeignet, ein CRPS auszuschließen.
Wenn keine komplizierenden Faktoren dazukommen und eine adäquate Therapie rechtzeitig eingeleitet wird, ist die Prognose eines CRPS nicht zwangsläufig schlecht. Mit 1 Jahr dauernden relevanten Schmerzen vor allem bei Belastung muss in den meisten Fällen gerechnet werden, oft auch länger.
Komplizierende, die Chronifizierung fördernde Faktoren sind schmerzhafte Therapieverfahren, ungerechtfertigte invasive Maßnahmen und psychische Komorbiditäten bzw. große Ängstlichkeit.
Wichtig ist die Abgrenzung von Traumafolgen, die nicht durch das CRPS selbst bedingt sind, aber von Patienten damit in Verbindung gebracht werden wie Knochenmarködeme, Arthrosen, myofasziale Beschwerden und Veränderungen proximaler Gelenke aufgrund der CRPS-assoziierten Schonhaltung (Beispiel ist die Einsteifung des Schultergelenkes durch Nichtgebrauch des Armes).
Realistische Therapieziele sind Schmerzkontrolle und weitgehende Wiedererlangung der Funktion. Allerdings bleibt häufig eine Restsymptomatik oder verminderte Belastbarkeit, was die Wiedereingliederung vor allem in körperlich anstrengende Berufe erschwert.
Die Therapie sollte immer eine Kombinationstherapie aus nicht medikamentösen und medikamentösen Maßnahmen sein. Nur in Ausnahmefällen sollten interventionelle Therapieformen zur Anwendung kommen. Die Mitarbeit der Patienten ist unerlässlich, aber ein schwer zu kalkulierender Faktor.
Die wesentlichen Bestandteile der CRPS-Therapie sind nach derzeitigem Kenntnisstand. Die folgende Reihung gibt keinen Empfehlungsgrad wieder, da Vergleichsstudien fehlen.
- Bisphosphonate
- Glukokortikoide bei akut posttraumatisch-entzündlichem CRPS (Rötung, Überwärmung, Ödem)
- Physio- und Ergotherapie (inkl. Spiegeltherapie, „Graded Motor Imagery“, Graded Exposure) zur Wiedererlangung der Funktion
- Medikamentöse Therapie chronischer (neuropathischer) Schmerzen (siehe entsprechende Leitlinie)
- Psychotherapeutische Verfahren (bei „Graded Exposure“ eingeschlossen)
- Bei Therapieresistenz Ketamindauerinfusion über 4 Tage zur Schmerztherapie (zunächst einmalig)
- Bei Therapieresistenz 10(–15) Sympathikusblockaden bei gesichert sympathisch- unterhaltenen Schmerzen in erfahrenen Zentren
- Rückenmarksnahe Elektrostimulation (SCS) bei chronischen, sonst unbehandelbaren Schmerzen (siehe S3-Leitlinie der AWMF). Die Spinalganglien (DRG)-Stimulation könnte der SCS gleichwertig oder überlegen sein, wenn aktuelle Ergebnisse repliziert werden.
- Intrathekale Gabe von Baclofen bei fokaler Dystonie.
Von den Autoren wird folgender Therapiealgorithmus vorgeschlagen:
Nach eingehender Anamnese, Untersuchung inklusive psychischer Exploration und ausführliche Erklärung der Erkrankung- Physio-/Ergotherapie und orale Pharmakotherapie chronischer Schmerzen als Basismaßnahme
- Bei akuter Symptomatik mit Ödem und Temperatursteigerung: Steroide oder Bisphosphonate
- Bei nicht ausreichender Wirksamkeit von A–B: intensive Evaluierung psychischer Komorbiditäten und deren Therapie
- Im Einzelfall einmalige stationäre Dauerinfusion von Ketamin nach individueller Titrierung, evtl. in Verbindung mit Punkt C. Hier gilt eine strenge Indikationsstellung, die lückenlose Überwachung der Patienten muss gewährleistet sein.
- Jegliche invasive Therapie nur bei Indikationsstellung durch spezialisierte Einrichtungen. Dies gilt auch für eine Serie mit limitierter Anzahl (ca. 10–15) von Sympathikusblockaden, wenn durch die einzelnen Blockaden eine deutliche Schmerzreduktion erzielt wird.
- Bei Kindern immer Behandlung durch ein erfahrenes Zentrum mit pädiatrischer Expertise ohne invasive oder potenziell schädigende (z.B. Ketamininfusionen) Therapie.
Inhalt
- 1 Einleitung
- 1.1 Begründung der Notwendigkeit der Leitlinie
- 1.2 Ziele der Leitlinie
- 1.3 Patientenzielgruppe
- 1.4 Versorgungsbereich
- 1.5 Adressaten der Leitlinie
- 1.6 Schlüsselwörter
- 2 Definition und Klassifikation
- 2.1 Begriffsdefinition
- 2.2 Klassifikation
- 2.3 Aspekte, die diese Leitlinie nicht behandelt
- 3 Diagnostik des CRPS
- 3.1 Präambel
- 3.2 Flussdiagramm Diagnostik
- 3.3 Diagnostik
- 4 Therapie des CRPS
- 4.1 Allgemeine Empfehlungen zur Therapie
- 4.2 Flussdiagramm Therapie
- 4.3 Systemische medikamentöse Therapie des CRPS
- 4.4 Topische medikamentöse Therapie des CRPS
- 4.5 Rehabilitative Therapie
- 4.6 Psychotherapeutische Verfahren
- 4.7 Interventionelle Therapie
- 4.8 Wirkungslose Therapien
- 4.9 Therapie des CRPS bei Kindern
- 5 Versorgungskoordination
- 6 Redaktionskomitee
- 7 Erklärung von Interessen und Umgang mit Interessenkonflikten.
- 8 Finanzierung der Leitlinie
- 9 Methodik der Leitlinienentwicklung
- 9.1 Zusammensetzung der Leitliniengruppe, Beteiligung von Interessengruppen
- 9.2 Recherche und Auswahl der wissenschaftlichen Belege
- 9.3 Verfahren zur Konsensfindung
- 10 Literatur.
- 11 Anhang
A 11.1 Erklärung von Interessen: tabellarische Zusammenfassung
1.1 Einleitung
A. 1.1 Begründung der Notwendigkeit der Leitlinie
Komplexe regionale Schmerzsyndrome (CRPS, alte Bezeichnungen: sympathische Reflexdystrophie, Morbus Sudeck) entwickeln sich mit variabler Latenz bei 2–5% der Patienten, die eine Verletzung einer Extremität erleiden, zum Beispiel eine Radiusfraktur, Operation oder eine Nervenverletzung jeglicher Art. Sprunggelenksfrakturen, intraartikuläre Frakturen, eine vorbestehende Erkrankung aus dem rheumatischen Formenkreis, vorbestehende chronische Schmerzen allgemein und ein weibliches Geschlecht sind Risikofaktoren für ein CRPS nach Trauma [Beerthuizen et al., 2012]. Die weitere Entwicklung des CRPS ist abhängig von noch nicht näher zu spezifizierenden Patientenfaktoren und ist z.B. nicht durch einen Operationsfehler erklärbar. Die epidemiologischen Daten aus zwei großen Studien legen nahe, dass die Inzidenz zwischen 5,5/100.000/Jahr [Sandroni et al., 2003] und 26,2/100.000/Jahr [de Mos et al., 2007] liegt. Die Altersverteilung folgt annähernd einer Normalverteilung mit einem Maximum zwischen dem 40. und dem 60. Lebensjahr [Veldman et al., 1993; Sandroni et al., 2003; de Mos et al., 2007]. Die Daten zur Prognose sind insgesamt noch unsicher, es ist aber beim Ausbleiben komplizierender Faktoren mit 50% weitgehenden Remissionen zu rechnen [Sandroni et al., 2003; Bean et al., 2016]. Vor allem bei zu später Diagnostik, falscher Therapiewahl und fehlender Berücksichtigung komplizierender psychischer, aber auch physischer Faktoren kann das CRPS chronisch werden und dann schwere funktionelle Behinderung nach sich ziehen, was wiederum oft signifikante sozialmedizinische und versorgungsrechtliche Folgen hat.
B. 1.2 Ziele der Leitlinie
Ziel dieser Leitlinie ist eine Optimierung der Erkennung und Behandlung komplexer regionaler Schmerzsyndrome. Die Leitlinie ist auf dem S1-Niveau evidenzbasiert.
C. 1.3 Patientenzielgruppe
Erwachsene mit CRPS I und CRPS II. Die Empfehlungen für Kinder sind rein informativ.
D. 1.4 Versorgungsbereich
Alle ambulanten und stationären Einrichtungen und Personen, die sich mit der Diagnostik und Therapie von Patienten mit CRPS beschäftigen.
E. 1.5 Adressaten der Leitlinie
Diese Leitlinie wendet sich an alle Ärzte, die Patienten mit CRPS betreuen.
F. 1.6 Schlüsselwörter
Komplexes regionales Schmerzsyndrom; chronischer Schmerz, posttraumatisch
2.2 Definition und Klassifikation
A 2.1 Begriffsdefinition
Unter einem CRPS versteht man ein Schmerzsyndrom nach Trauma einer Extremität, bei dem die Schmerzen im Vergleich zum erwarteten Heilungsverlauf unangemessen stark sind und bei dem sich Störungen der Sensorik, Motorik, des vegetativen Nervensystems und der Gewebetrophik finden. Wichtig ist festzuhalten, dass diese Symptome nicht mehr auf direkte Traumafolgen zurückzuführen sind. Die Symptome müssen deshalb außerhalb (in der Regel distal) der Traumastelle auftreten und dürfen sich nicht auf das Innervationsgebiet eines peripheren Nerven oder einer Nervenwurzel (cave Plexusläsion) beschränken. Einzelne Akren können ausgespart sein. Bei isoliertem Befall großer Gelenke ohne akrale Beteiligung sollte die Diagnose CRPS nur mit größter Zurückhaltung in Betracht gezogen werden.
Sensorik:
Es finden sich regelhaft Schmerzen und Sensibilitätsstörungen. Die Schmerzen sind meist bereits in Ruhe vorhanden und immer bei Belastung verstärkt. An den periartikulären Strukturen findet sich fast regelhaft eine gesteigerte Druckschmerzhaftigkeit (Druckhyperalgesie), deren Vorhandensein die Diagnose CRPS stützt [Mainka et al., 2014]. Auf der Haut hat eine Subgruppe der Patienten eine mechanische und thermische Hyperalgesie [Gierthmuhlen et al., 2012]. Weiterhin finden sich bei CRPS charakteristische Störungen der Körperwahrnehmung und des Körperschemas (Neglect-like-Symptome) [Frettloh et al., 2006; Lewis et al., 2010; Reinersmann et al., 2010; Reinersmann et al., 2012; Kolb et al., 2012], die ebenfalls typisch für CRPS sind.
Motorik:
Im Vordergrund stehen eine Einschränkung der aktiven und passiven Beweglichkeit, Störungen der Feinmotorik, schmerzbedingte Kraftminderung bis hin zu Pseudoparesen. Seltener kommen Tremor, Myoklonien und fixierte Dystonien vor [Harden et al., 2010b].
Autonomes Nervensystem: Betroffen sind Hautdurchblutung (Änderungen von Hauttemperatur und Hautfarbe), das Schwitzen und das Extremitätenvolumen (Ödem). Diese Symptome ändern sich individuell im Verlauf sehr stark [Birklein et al., 1998].
Trophische Störungen: Sie finden sich an Hautanhangsgebilden (Haare, Nägel), im Bindegewebe, in Muskeln und Knochen [Birklein et al., 2000; Baron & Janig, 2004]. Durch die trophischen Veränderungen kommt es unbehandelt rasch zu Bewegungseinschränkung, Kontrakturen und teilweise schwer behandelbaren Gelenkfehlstellungen. Sekundär können auch proximale Extremitätenanteile und Gelenke (Schulter, Knie, Ellbogen, Hüftgelenk) betroffen sein.
Psychologische Faktoren: Während kritische Lebensereignisse Risikofaktoren für die Entstehung eines CRPS darstellen [Geertzen et al., 1998], fand eine aktuelle Metaanalyse darüber hinaus keine eindeutige Konstellation psychologischer Faktoren, die für die Entwicklung eines CRPS prädisponieren [Beerthuizen et al., 2009; Beerthuizen et al., 2011; Beerthuizen et al., 2012]. Wie bei vielen chronischen Erkrankungen (insbesondere Schmerzerkrankungen) gesellen sich sekundäre psychische Veränderungen dazu, die dann zwar nicht als kausal anzusehen sind, aber den Verlauf und die Therapie beeinflussen. Bei Patienten mit gravierender psychischer Vortraumatisierung [Speck et al., 2017] oder Erkrankung kommt es aber nicht selten zu einer Dekompensation der Vorerkrankung und dadurch auch zu einem komplikationsreichen Verlauf des CRPS. Außerdem finden sich häufig aggressive und dependente Verhaltensweisen, eine erhöhte Ängstlichkeit [Dilek et al., 2012] und Affektlabilität sowie Schlafstörungen, depressive Stimmungen, verbunden mit Selbstwert- und Selbstbildproblemen [Frettloh et al., 2003], was vor allem die Therapierbarkeit beeinflussen kann [Bean et al., 2015]. Daher hat die frühe psychologische Diagnostik und Therapie(-begleitung) eine zentrale Bedeutung, ohne die vor allem bei schwerem Verlauf oder bei Therapieresistenz eine rein medizinische Behandlung scheitern wird [Maier & Baron, 2003].
B. 2.2 Klassifikation
Bezüglich der Klassifikation des CRPS finden sich zwei sinnvolle Unterscheidungen:
Wenn es bei der Schädigung zu einer nachweisbaren Verletzung größerer peripherer Nerven kommt, spricht man von CRPS II, andernfalls von CRPS I [Stanton-Hicks et al., 1995; Oaklander et al., 2006].
Eine weitere mögliche Unterscheidung betrifft die Hauttemperatur zu Beginn der CRPS- Symptomatik. Ca. 70% der Patienten haben eine warme, entzündlich veränderte Haut, die restlichen 30% eine kalte, livide Haut [Bruehl et al., 2016]. Diese Unterscheidung hat möglicherweise Implikationen für den Verlauf. Patienten mit primär kaltem CRPS haben eine schlechtere Prognose [Vaneker et al., 2005].
C. 2.3 Aspekte, die diese Leitlinie nicht behandelt
Diese Leitlinie kann keine Übersicht über die Pathophysiologie des CRPS bieten, ebenso wenig wie zur sicherlich sehr komplexen Begutachtung (Rentenversicherung, BG, private Unfallversicherung), die dann nötig wird, wenn es sich um Unfallverletzungen als Auslösefaktoren handelt.
3.3 Diagnostik des CRPS
A. 3.1 Präambel
Die Diagnose „CRPS“ ist eine klinische Diagnose. Deshalb sind die Anamneseerhebung, die klinische und neurologische Untersuchung die entscheidenden Schritte in der Diagnosefindung. Im Prinzip gilt, dass für die Diagnosestellung ärztlich erhobene und dokumentierte Befunde wichtiger sind als die alleinige Beschwerdenschilderung. Ein wesentliches Merkmal des CRPS ist, dass die Symptome „generalisieren“, d.h. fast die gesamte distale betroffene Extremität erfassen. Man muss fordern, dass die Diagnose CRPS in zeitlichem Zusammenhang mit dem Trauma erfolgt. Ein sinnvoller Zeitraum dabei wären ca. 2– 3 Monate, dann müssen die Diagnosekriterien erfüllt sein. Diagnosen nur auf Grund einer Schmerzpersistenz zum Teil Jahre nach dem Trauma sind nicht selten Verlegenheitsdiagnosen [Birklein & Schlereth, 2013]. Eine „red flag“ nach Radiusfraktur ist ein persistierender Schmerz der Stärke ≥ 5 von 10 eine Woche nach Fraktur [Moseley et al., 2014].
B. 3.2 Flussdiagramm Diagnostik
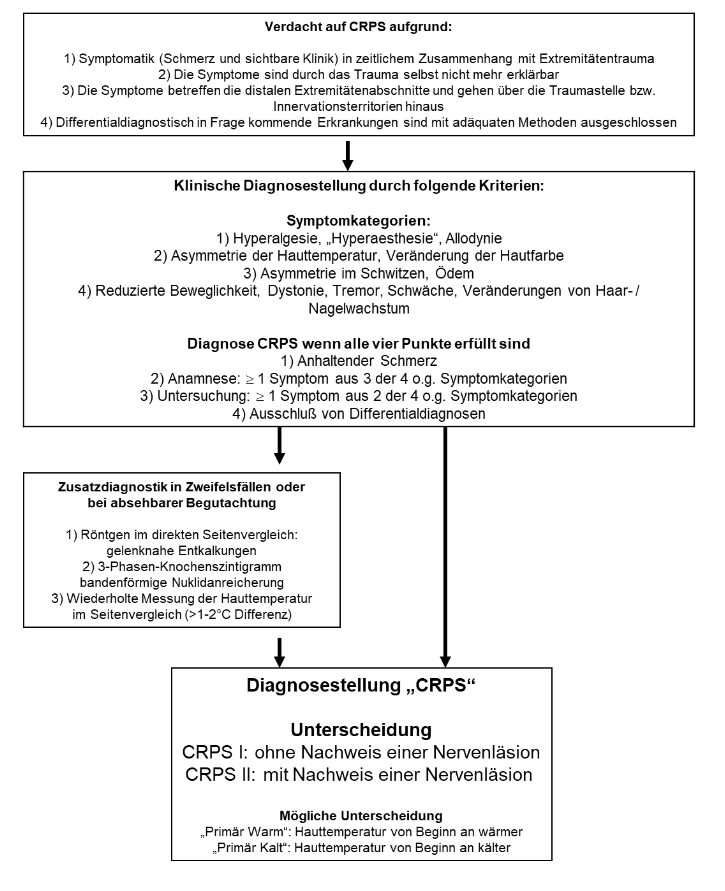
C. 3.3 Diagnostik Basisdiagnostik
Von der Internationalen Gesellschaft zum Studium des Schmerzes (IASP) wurden die sensitiven (99%) und moderat spezifischen (68%) rein klinischen Kriterien zur Diagnosestellung anerkannt [Harden et al., 2010a]. Es müssen alle Punkte 1 bis 4 erfüllt sein. Ein besonderes Augenmerk sollte immer auf Punkt 4 gelegt werden. Die Diagnose CRPS erfordert eine große Sorgfalt.
- Anhaltender Schmerz, der durch das Anfangstrauma nicht mehr erklärt wird
- Die Patienten müssen über jeweils mindestens 1 Symptom aus 3 der 4 folgenden Kategorien in der Anamnese berichten:
- Hyperalgesie (Überempfindlichkeit für Schmerzreize); „Hyperästhesie“ (Überempfindlichkeit für Berührung, Allodynie)
- Asymmetrie der Hauttemperatur; Veränderung der Hautfarbe
- Asymmetrie des lokalen Schwitzens; Ödem
- Reduzierte Beweglichkeit, Dystonie, Tremor, „Paresen“ (im Sinne von Schwäche); Veränderungen von Haar- oder Nagelwachstum
- Bei den Patienten müssen jeweils mindestens 1 Symptom aus 2 der 4 folgenden Kategorien zum Zeitpunkt der Untersuchung vorliegen:
- Hyperalgesie auf spitze Reize (z.B. Zahnstocher); Allodynie; Schmerz bei Druck auf Gelenke/Knochen/Muskeln
- Asymmetrie der Hauttemperatur; Veränderung der Hautfarbe
- Asymmetrie des lokalen Schwitzens; Ödem
- Reduzierte Beweglichkeit, Dystonie, Tremor, „Paresen“ (im Sinne von Schwäche); Veränderungen von Haar- oder Nagelwachstum
- Eine andere Erkrankung erklärt die Symptomatik nicht hinreichend.
Obwohl in den Diagnosekriterien nicht unbedingt gefordert, sollte die Hauttemperatur mit geeigneten Instrumenten gemessen werden, alle anderen Symptome werden klinisch beurteilt. Um Punkt 4 beantworten zu können, müssen differenzialdiagnostisch insbesondere folgende Erkrankungen, die ein CRPS vortäuschen können, ausgeschlossen sein: Erkrankungen des rheumatischen Formenkreises, Entzündungen (z.B. erregerbedingte Arthritiden, Infektionen nach Operationen, Polyneuritiden, Polyradikulitiden, Plexusschädigungen), thromboembolische Erkrankungen, Kompartment- und Nervenkompressionssyndrome. Hierzu dienen u.a. auch laborchemische Untersuchungen. Das CRPS selbst ist nicht durch Auffälligkeiten bei Routinelaborparametern wie z.B. CRP-Erhöhung oder BSG-Beschleunigung gekennzeichnet. Oft nicht einfach ist die Abgrenzung von den Folgen psychischer Erkrankungen, vor allem bei Vorliegen einer dissoziativen Störung mit autoagressiven Handlungen. Der Verlauf der Erkrankung sollte mit in der Schmerztherapie üblichen Methoden unter Einschluss von Schmerzquantifizierung, Funktionsparametern (Kraft, Bewegungsumfang, Umfangsmessung) und vegetativen Funktionsstörungen dokumentiert werden. Die Anwendung der CRPS-Schwereskala CSS [Harden et al., 2010b] bietet die Möglichkeit, nicht nur eine Graduierung der CRPS-Schwere vorzunehmen, sondern auch den Verlauf zu dokumentieren [Harden et al., 2017].
Klinische und apparative bestätigende Diagnostik
Je länger ein CRPS besteht, umso schwieriger ist die Abgrenzung von den Veränderungen durch chronischen Nicht- oder Mindergebrauch anderer Ursache. Hilfreich ist eine Bilddokumentation der betroffenen Extremität in allen Krankheitsstadien.
Es gibt Befunde, welche die Diagnose CRPS, die anhand der o.g. Diagnosekriterien gestellt wird, bestätigen bzw. andere Diagnosen ausschließen können.
** Eine Spezifizität von 75% (bei einer Sensitivität von 40%) für die klinische Diagnose „CRPS“ hat ein Wert von >/= 4 auf einem Fragebogen, der Aufmerksamkeitsphänomene für die betroffene Extremität abfragt [Frettloh et al., 2006]. Dieser Fragebogen ist eine Selbstauskunft. Je höher der Wert (maximal 6), desto größer wird die Spezifität, während die Sensitivität kleiner wird.
** An den periartikulären Strukturen findet sich fast regelhaft eine gesteigerte Druckschmerzhaftigkeit (Druckhyperalgesie), deren Vorhandensein die Diagnose CRPS stützen kann. In einer relativ kleinen Studie (n = 18 CRPS vs. 16 Schmerzkontrollen) [Mainka et al., 2014] wurden die Druckschmerzschwellen über allen proximalen Interphalangealgelenken der betroffenen Hand gemittelt. Wenn der Wert 102 kPA oder darunter betrug (Druckschmerzhyperalgesie), dann konnte die klinische Diagnose CRPS mit einer Spezifität von 94% (bei einer Sensitivität von 82%) bestätigt werden. Dies gilt nur für das CRPS der oberen Extremität.
Apparative Diagnostik kann ebenfalls zur Bestätigung der klinischen Diagnose CRPS verwendet werden.
** Die qualitative Auswertung eines 3-Phasen-Knochenszintigramms (bandenförmige gelenknahe Anreicherungen) mit Technetium-99m-Diphosphonat hat eine ca. 30–50%ige Sensitivität, aber hohe Spezifität (bis 100%) (Schurmann et al., 2007; Wuppenhorst et al., 2010). Die quantitative Auswertung der Anreicherung im Bereich der metacarpo- phalangealen und der proximalen und distalen interphalangealen Gelenke mittels einer Region of Interest (ROI)-Analyse im Seitenvergleich (Quotient >/= 1,32) ist sensitiver (69%) bei 75%iger Spezifität (Wuppenhorst et al., 2010) bei CRPS im ersten Jahr der Erkrankung.
** Die Messung des Osteoblastenaktivitätsmarkers Osteoprotegerin im Serum kann möglicherweise die 3-Phasen-Knochenszintigraphie ersetzen oder ergänzen (Kramer et al., 2014), wenn das positive Ergebnis in einer unabhängigen Studie repliziert ist.
[ Die wiederholte Messung (Wasner et al., 2002) oder die Langzeitmessung (über 7 Stunden) (Krumova et al., 2008) der Hauttemperatur im Seitenvergleich ist ebenfalls geeignet, die Diagnose CRPS zu unterstützen. Temperaturunterschiede von > 1–2 °C sind zwar nicht beweisend, unterstützen aber die Diagnosestellung. Spezifischer sind rechts-links- asynchrone Schwankungen und Oszillationen der Hauttemperatur, welche sich aber nur durch die kontinuierliche Langzeitmessung nachweisen lassen (Krumova et al., 2008).
** In der konventionellen Röntgenaufnahme zeigen circa 50% der Patienten nach 4–8 Wochen generalisierte, kleinfleckige, osteoporotische, gelenknahe Veränderungen. Die Aufnahmen sollten im Seitenvergleich durchgeführt werden, um die Sensitivität zu erhöhen [Gradl et al., 2003]. Zur Verlaufskontrolle des CRPS sind Röntgenaufnahmen oder CTs aber nicht indiziert. Eine große Verwechslungsgefahr besteht mit der Inaktivitätsosteoporose. Die Kernspintomographie wird oft aus differenzialdiagnostischen Gründen durchgeführt, ist wegen ihrer sehr geringen Spezifität für die Diagnosestellung eines CRPS aber nicht geeignet [Graif et al., 1998]. Vor allem sind Knochenödeme, z.B Bone Bruises, nicht geeignet, die Diagnose CRPS zu sichern.
Bei anhand Anamnese und Befund klinisch sicherem CRPS ist keine Zusatzdiagnostik erforderlich. Bei unsicherer klinischer Diagnose, z.B. bei spontaner Symptomentwicklung, oder bei absehbaren Begutachtungen (z.B. nach Berufsunfällen) empfehlen wir, frühzeitig zumindest eine Knochenszintigraphie zu veranlassen. Die weitere Diagnostik muss individuell veranlasst werden und richtet sich nach den möglichen Differenzialdiagnosen.
4.4 Therapie des CRPS
A. 4.1 Allgemeine Empfehlungen zur Therapie
Es ist ein grundsätzliches Problem vieler Studien zur Therapie des CRPS, dass sie nicht genügend zwischen der Wirksamkeit auf Schmerzen, Funktion oder klinischer Symptomatik differenzieren. Noch nicht publizierte Ergebnisse einer abgeschlossenen europaweiten Befragung von CRPS-Patienten ergaben, dass für die Patienten die Schmerzreduktion das wichtigste Therapieziel ist. Die Funktionsverbesserung kommt erst danach. Eine weitere Schwierigkeit ist, dass vermutlich die Therapierbarkeit in verschiedenen Stadien unterschiedlich ist. Therapiekonzepte zu anderen neuropathischen Schmerzerkrankungen sind ebenfalls nur bedingt übertragbar.
Dementsprechend ist die Qualität der Interventionsstudien bei CRPS generell niedrig [O’Connell et al., 2013]. Dieser Mangel muss bei der Bewertung der Studienergebnisse generell bedacht werden.
Der Erfolg der Behandlung des CRPS hängt auch davon ab, dass möglichst frühzeitig eine multidisziplinäre Therapie bereitgestellt wird. Hiermit kann in Abhängigkeit von Verlauf und Schweregrad die Behandlung der Schmerzen mit der des Funktionsverlustes und der einer evtl. vorhandenen psychischen Begleitstörung verbunden werden.
Eine solche multimodale Therapie könnte in ihren Grundzügen wie folgt aufgebaut sein, wozu es allerdings keine validierten Studien gibt. Die für CRPS spezifische Therapie wird im Anschluss berichtet.
- Schon zu Beginn der Erkrankung sollten Bewegungen vorsichtig und unter aktiver Mitarbeit der Patienten initiiert werden. Passive Maßnahmen, die gegen den Willen und ohne Kontrolle durch den Patienten angewandt werden und zu einer Schmerzverstärkung führen, sind kontraindiziert, da sie die weitere Mitarbeit der Patienten verhindern, das CRPS aggravieren und so die funktionelle Restitution durch Ausbildung von Kontrakturen bei Vermeidung von Bewegung unmöglich machen können. Oft sind hier Analgetika zumindest teilweise wirksam und sollten zur Erlangung dieser Therapieziele auch versucht werden.
- Danach treten neuro- und gelenkrehabilitative Verfahren in den Vordergrund. Schrittweise wird die Aktivierung immer wichtiger, während die Schmerztherapie in den Hintergrund tritt.
- Die Behandlung der funktionellen Störungen (Bewegung, Sensorik) erfolgt in der dritten Stufe. Hier rücken die funktionell-orthopädische-psychologische Rehabilitation und die psychosoziale Reintegration in den Vordergrund der Behandlung. Eine medikamentöse Schmerztherapie ist häufig nur noch begrenzt erforderlich [Maier & Baron, 2003].
Präambel
Im Folgenden werden nur Medikamente/Verfahren gelistet, die in mindestens einer randomisierten, kontrollierten Therapiestudie (RCT) mit einer Fallzahl von n >/= 10 bei CRPS positive Resultate (im primären Endpunkt, sofern definiert) erbracht haben. RCTs, die die ersten positiven Ergebnisse widerlegen, werden ebenfalls wiedergegeben. Auf eine Vielzahl von weiteren Therapien und Verfahren, die teils kasuistisch berichtet wurden, ausschließlich negative Ergebnisse lieferten oder ungewöhnliche, wissenschaftlich nicht begründbare Therapieformen darstellen, wird nicht oder nicht detailliert eingegangen.
B. 4.2 Flussdiagramm Therapie
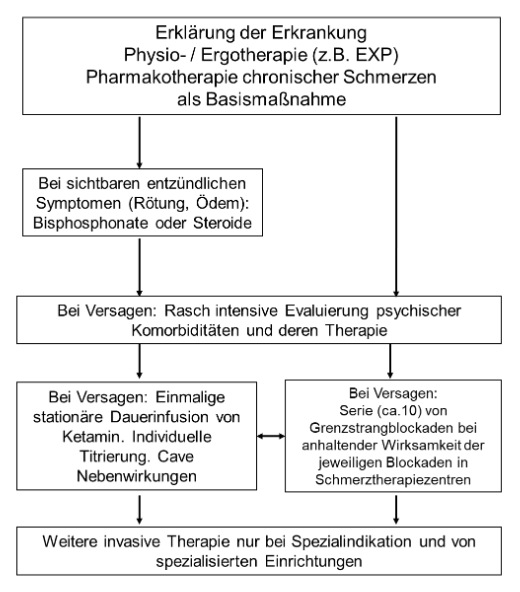
C. 4.3 Systemische medikamentöse Therapie des CRPS
Bisphosphonate
Empfehlung: Bisphosphonate sind bei CRPS der oberen und unteren Extremität bezüglich Schmerz, Funktion und Selbsteinschätzung der Patienten wirksam und können somit empfohlen werden. Gesicherte Aussagen, bis wann im Verlauf eines CRPS der Einsatz von Bisphosphonaten gerechtfertigt ist, sind derzeit nicht möglich. Die Dosis von Alendronat p.o., die in der entsprechenden Studie verwendet wurde, ist ungewöhnlich hoch.
Wirkungsweise: Bisphosphonate hemmen die Osteoklastenaktivität, wirken längerfristig entzündungshemmend und modulieren die spinale Mikroglia.
Es gibt verschiedene Analoga. Bei den oralen Bisphosphonaten besteht grundsätzlich das Problem der unzuverlässigen Resorption (~ 1%).
Evidenz: Zur Therapie des CRPS mit Bisphosphonaten liegen fünf RCTs vor, die alle einen signifikanten Effekt der Bisphosphonate im Vergleich zu Placebo auf Schmerz und Funktion belegen. Der Beobachtungszeitraum war bis zu 3 Monate. Die eingesetzten Bisphosphonate waren Alendronat i.v. (n = 10) [Adami et al., 1997] oder per os (n = 40) [Manicourt et al., 2004], Clodronat i.v. (n = 32) [Varenna et al., 2000], Pamidronat i.v. (n = 13) [Robinson et al., 2004] und Neridronat i.v. [Varenna et al., 2013]. Die meisten der in die Studien eingeschlossenen Patienten hatten eine im Röntgenbild nachgewiesene gelenknahe Osteoporose. Aussagen, ob sich die Wirksamkeit der Bisphosphonate zwischen akuten und chronischen Phasen des CRPS unterscheidet, lassen sich nicht treffen. Pathophysiologisch machen Bisphosphonate in akuten Krankheitsstadien mehr Sinn.
Dosierung: Alendronat wird entweder oral in der hohen Dosis von 40 mg /Tag über 8 Wochen verabreicht oder i.v. 7,5 mg an 3 aufeinanderfolgenden Tagen. Clodronat wird in der Dosis 300 mg an 10 aufeinanderfolgenden Tagen i.v. gegeben, Pamidronat einmalig in der Dosis 60 mg und Neridronat viermalig je 100 mg jeden dritten Tag.
Unerwünschte Wirkung: Bisphosphonate reizen die Schleimhäute. Die Nebenwirkungen äußern sich daher hauptsächlich in Form von Übelkeit, Aufstoßen, Sodbrennen, Magenschmerzen oder Krämpfen. Orale Bisphosphonate sollten daher morgens nüchtern im Stehen mit einem großen Glas Leitungswasser eingenommen werden. Anschließend dürfen sich die Patienten für mindestens eine halbe Stunde nicht hinlegen. Weiterhin werden Fieber und grippeartige Symptome berichtet. Die gravierendste Nebenwirkung sind Osteonekrosen am Kiefer. Eine zahnärztliche Vorstellung zu Beginn der Therapie wird dringend empfohlen.
Steroide
Empfehlung: Aufgrund der positiven Ergebnisse der Studien und eigener Erfahrungen kann trotz der geringen Fallzahl eine Empfehlung für den Einsatz von Steroiden bei frühen entzündlichen (Rötung, Überwärmung, Ödem) CRPS-Fällen gegeben werden. Für den Einsatz der Steroide spricht weiterhin, dass das Therapieergebnis innerhalb weniger Tage (bis maximal 3 Wochen) beurteilt werden kann. Bei chronischem CRPS (> 6 Monate Dauer) sind Steroide in Einzelfällen wirksam, aber in der Mehrzahl der Fälle nicht. Dagegen sprechen die üblichen Kontraindikationen für den Einsatz der Steroide. Eine sichere Empfehlung für Dosis oder Therapiedauer kann derzeit nicht gegeben werden, die Indikation zu einer Dauertherapie besteht nicht.
Wirkungsweise: Glukokortikoide haben einen antiinflammatorischen und antiödematösen Effekt, den sie über die Bindung an Glukokortikoidrezeptoren am Zellkern und ihre direkte Wirkung auf Zellmembranen entfalten.
Evidenz: Steroide werden seit den 1970er Jahren in der Therapie des CRPS eingesetzt. Neben offenen Studien [Kozin et al., 1981; Braus et al., 1994; Grundberg, 1996] gibt es zwei RCTs, die die Wirksamkeit von Steroiden belegen. In einer kleinen Studie (n = 13) beeinflusste Prednisolon die Symptome bei posttraumatischem CRPS I signifikant besser als Placebo [Christensen et al., 1982], und später wurde dieses Ergebnis in einer größeren Studie (n = 60) bei CRPS nach Schlaganfall im Vergleich zu NSAID repliziert [Kalita et al., 2006]. Kritisch ist anzumerken, dass in letztgenannter Studie die Inzidenz von Post-Stroke-CRPS ungewöhnlich hoch war.
Es gibt auch negative Untersuchungen bei CRPS I. Eine offene 2-Zentren-Studie an 31 Patienten mit CRPS von durchschnittlich 15 Monaten Erkrankungsdauer und vorher erfolgloser Therapie konnte keine signifikante Schmerzreduktion (Funktion wurde nicht überprüft) durch Glukokortikoide (100 mg Prednisolon, abdosiert innerhalb 2 Wochen oder 60 mg Prednisolon, nach 3 Wochen abdosiert) nachweisen (p = 0,059). Nur in Einzelfällen war die Wirksamkeit deutlich (Barbalinardo et al., 2015). In einer weiteren Studie (n = 10) wurde Methylprednisolon 40 mg (+ Lidocain 10 ml 2%) einmal pro Woche insgesamt dreimal in einem modifizierten Bier- Block (Abschnürung der Extremität) verabreicht [Taskaynatan et al., 2004]. Die Patienten besserten sich unter der Therapie, das Ergebnis war aber von der Placebogruppe (Lidocain
10 ml 2%) nicht verschieden. In einer weiteren Studie mit chronischen CRPS-Patienten (n = 21) war die einmalige intrathekale Applikation von 40 mg Methylprednisolon bezüglich Schmerz und Funktionsverbesserung ebenfalls nicht wirksam. Den beiden letzten Studien ist gemeinsam, dass die Applikationsformen, die Dosis (Applikationshäufigkeit) oder das Krankheitsstadium ungeeignet waren, um einen Steroideffekt belegen zu können. Bei der anderen negativen Studie [Barbalinardo et al., 2015] wurde möglicherweise die falsche CRPS- Population (chronische Fälle) untersucht.
Dosierung: Aufgrund der bisherigen Studienlage kann ein Prednisolonäquivalent von 30–40 mg/Tag über 4 Wochen bei akutem CRPS (bis 6 Monate Dauer) gegeben werden. Diese Dosierung ist nur ein Anhaltspunkt. Die Autoren selbst haben bessere Erfahrungen mit initial deutlich höheren Dosen Prednisolonäquivalent (>/= 100 mg oral), was dann über 2,5 Wochen ausgeschlichen wird. Eine individuelle Anpassung ist oft nötig, einer Wiederholung der Behandlung bei Wiederauftreten der Symptome kann notwendig werden.
Unerwünschte Wirkung: Es gibt alle bekannten und zum Teil obligatorischen Nebenwirkungen einer Steroidtherapie. Deren Ausprägung ist bei oben vorgeschlagener Dosis und Dauer aber nur mäßig.
N-Acetylcystein (NAC)
Empfehlung: NAC kann bei Patienten mit kaltem CRPS versucht werden. Dies ist eine „Kosten- Nutzen“-Abwägung. Die Evidenz zur Wirksamkeit ist klein, NAC ist aber so gut wie nebenwirkungsfrei.
Wirkungsweise: NAC fängt freie Radikale, die bei Entzündungen und Ischämien entstehen.
Evidenz: Zur Wirksamkeit von NAC bei CRPS gibt es eine RCT, in der oral verabreichtes NAC zu Dimethylsulfoxid (DMSO)-Creme verglichen wurde [Perez et al., 2003]. NAC war genauso effektiv wie DMSO. Unter der Prämisse, dass DMSO-Creme bei CRPS wirkt (siehe unten), kann auf eine Wirksamkeit von ACC geschlossen werden, ganz besonders bei primär kalten CRPS- Fällen. Da aber orales NAC nur eine Resorptionsrate von 10% aufweist und neuere Studien die Wirksamkeit von oralem NAC bei seiner ursprünglichen Indikation (COPD [Decramer et al., 2005]) anzweifeln, bedarf es einer erneuten Überprüfung dieser Substanz. Dies gilt insbesondere, weil mehrere, zum Teil qualitativ gute, doppelt blinde RCT-Studien keine Wirksamkeit des Radikalfängers Mannitol nachweisen konnten [Perez et al., 2008; Tan et al., 2010].
Dosierung: 3 x 600 mg am Tag.
Unerwünschte Wirkungen: keine nennenswerten.
Medikamente gegen Schmerzen bei CRPS
Nur Gabapentin und Ketamin wurden als Medikamente gegen Schmerzen bei CRPS in RCTs untersucht. Die teilweise neuropathische Natur der Schmerzen bei CRPS gestattet nach Meinung der Autoren allerdings gewisse Analogschlüsse auch in Bezug auf andere Medikamente oder topische Therapien. An diesem Punkt soll deshalb hier ausdrücklich auf die Leitlinie „Therapie neuropathischer Schmerzen“ verwiesen werden.
Gabapentin
Empfehlung: Der Einsatz von Gabapentin zur Therapie der Schmerzen und Sensibiltitätsstörungen bei CRPS kann mit Einschränkungen empfohlen werden.
Wirkungsweise: Eine Wirkung auf die α2/δ-Untereinheit neuronaler Kalziumkanäle gilt als gesichert.
Evidenz: Gabapentin speziell bei CRPS (n = 58) wurde nur in einer RCT untersucht, der Effekt war gering positiv, mehr in Bezug auf Sensibilitätsstörungen denn auf die Schmerzen [van de Vusse et al., 2004]. Für das ähnlich wirkende Pregabalin existiert keine Studie zu CRPS.
Dosierung: Startdosis: 300 mg. Steigerung: täglich um 300 mg bis auf 1200–2400mg in drei Einzeldosen. Dosis-Max.: 3600 mg.
Unerwünschte Wirkungen: vor allem anfänglich Müdigkeit und Schwindel, bei längerer Anwendung Gewichtszunahme.
Ketamin und Memantine (NMDA-Rezeptor-Antagonisten)
Empfehlung: Der Einsatz von i.v. Ketamin als Analgetikum zur Therapie der Schmerzen bei CRPS kann aufgrund von 2 positiven RCTs trotz Vorbehalten der Autoren (unvollständige Verblindung durch obligate Ketaminnebenwirkungen in den RCTs; Lebertoxizität; kognitive Einschränkungen; Gefahr von Missbrauch) zur Anwendung in erfahrenen Zentren empfohlen werden. Memantine in Kombination mit Morphin kann aufgrund unzureichender Datenlage nicht empfohlen werden. Hierzu müssen weitere Studien folgen.
Wirkungsweise: Ketamin (stark) und Memantine (schwach) blockieren NMDA-Rezeptoren im peripheren und vor allem im zentralen Nervensystem. Für Ketamin ist die analgetische/ antihyperalgetische Wirksamkeit in Studien außerhalb der Indikation CRPS belegt, für Memantine nicht.
Evidenz: Zur Wirksamkeit von systemischem Ketamin i.v. auf die Schmerzen bei CRPS wurden in den letzten Jahren zwei doppelt blinde RCTs durchgeführt. Beide Studien waren positiv. In die wichtigste Studie [Sigtermans et al., 2009] wurden 60 Patienten mit chronischem CRPS (7,5 Jahre Dauer) eingeschlossen. Die Therapie erfolgte als Dauerinfusion über vier Tage. Die Dosis wurde individuell nach Wirksamkeit und Nebenwirkung titriert, im Mittel lag sie bei 22,2 mg/h bei 70 kg Körpergewicht. Die Schmerzreduktion in der Verumgruppe war hoch signifikant
stärker und hielt länger (bis zu 12 Wochen) an als in der Placebogruppe. Die Wirkung auf die Funktion der erkrankten Extremität war vergleichsweise gering [Schilder et al., 2013]. Die zweite Studie mit 19 Patienten [Schwartzman et al., 2009] bestätigte das Ergebnis (Schmerzreduktion für 12 Wochen; kein/geringer Effekt auf Funktion), wobei hier aber ein 10- tägiger Infusionszyklus (täglich 4h) mit 0,35 mg/kg/h (max. 100 mg/Tag) Ketamin (nach anfänglicher Titration) durchgeführt wurde. Auffällig bei dieser Studie war die fehlende Antwort in der Placebogruppe, was auf eine inkomplette Verblindung hindeutet.
Zur Wirksamkeit von oralem Memantine (40 mg) in Kombination mit Morphin (30 mg) wurde eine doppelt blinde RCT mit 20 CRPS-Patienten durchgeführt [Gustin et al., 2010]. Memantine in Kombination mit Morphin war wirksamer als Morphin alleine bezüglich Schmerz in Ruhe und bei Bewegung und bezüglich der Stimmung. Zusätzlich war die Aktivierung schmerzrelevanter somatosensorischer Hirnregionen bei Bewegung im fMRT unter Memantine kleiner.
Dosierung: individuell nach Wirksamkeit titrierte Dauerinfusion mit 22,2 mg/h/70 kg Ketamin über 4 Tage; oder fix 0,35 mg/kg/h (max. 100 mg) über 4 Stunden für 10 Tage hintereinander. Memantine in der Dosis 40 mg/Tag als Add-on zu Morphin, für das selbst aber keine Wirksamkeit in der Therapie des CRPS nachgewiesen wurde.
Unerwünschte Wirkungen: die typischen Nebenwirkungen von Ketamin und Memantine wie Übelkeit, Erbrechen, Schwindel, Müdigkeit, psychomimetische Effekte, dysphorische Stimmung, Abhängigkeit. Des Weiteren besteht die Gefahr von Lebertoxizität bei Wiederholung der Ketamininfusionen [Noppers et al., 2011] bzw. von kognitiven Problemen bei Dauerbehandlung [Kim et al., 2016].
D. 4.4 Topische medikamentöse Therapie des CRPS Dimethylsulfoxid (DMSO)
Empfehlung: DMSO ist in den Niederlanden Standardtherapie des CRPS. In den Augen der Autoren ist die Studienlage aber zu unklar, um eine eindeutige Empfehlung abzugeben.
Wirkungsweise: DMSO penetriert die Haut und fängt freie Radikale, die bei Entzündungen und Ischämien entstehen.
Evidenz: Zur Behandlung des CRPS mit 50% DMSO-Creme gibt es eine Studie (n = 32), die DMSO mit Placebo vergleicht (Zuurmond et al., 1996). Nach 2 Monaten war das Outcome der mit DMSO behandelten Patienten in Bezug auf Schmerz und Funktion signifikant besser. Aufbauend auf diese Studie, wurde in einer größeren RCT-Untersuchung (n = 146) der gleichen Arbeitsgruppe [Perez et al., 2003] DMSO mit NAC oral (siehe oben) verglichen. Das Ergebnis war bei beiden Therapieformen im Wesentlichen gleich. Ein signifikanter Unterschied zur ersten DMSO Studie bestand: Statt neutral riechendem Placebo wurde eine ähnlich charakteristisch wie DMSO riechende Placebobehandlung gewählt. Dies lässt 2 mögliche Interpretationen zu: Entweder DMSO und NAC sind gleich wirksam, oder, wenn die erste Studie nicht wirklich verblindet war, könnten auch beide Therapieformen gleich unwirksam sein.
Dosierung: 50% DMSO wird in fettige Creme (Vaseline) gemischt und 5-mal/Tag auf die betroffene Extremität aufgetragen.
Unerwünschte Wirkungen: Es kann zu lokalen Hautirritationen kommen. Letztlich besteht zumindest theoretisch die Möglichkeit der Karzinogenität von DMSO.
E. 4.5 Rehabilitative Therapie
Studien zur Wirksamkeit einer aktiven Therapieform sind naturgemäß nicht „verblindet“ im Sinne von Pharmastudien, sollten aber kontrolliert sein. Die prinzipiellen Therapieziele sind Erhalt bzw. Verbesserung von Beweglichkeit und Funktion. Manchmal ist auch eine spezifische Hilfestellung zur Integration der Behinderung in den Alltag nötig.
Empfehlung: Für die funktionelle Rehabilitation von CRPS-Patienten sind sowohl Physio- als auch Ergotherapie, die sich individuell an der Symptomatik der Patienten orientieren und kompetent durchgeführt werden, unverzichtbar. Die Wirksamkeit einer interdisziplinären rehabilitativen Therapie ist belegt [Singh et al., 2004].
Physiotherapie
Wirkungsweise: Die Physiotherapie im herkömmlichen Sinne soll pathologische Bewegungsmuster kompensieren und eine adäquate Funktion wiederherstellen. Dies verhindert auch Spätschäden wie Kontrakturen durch „Nichtgebrauch“ (Vermeidung von Schmerzen, „learned non-use“) der schmerzhaften Extremität [Barnhoorn et al., 2015]. Zur Ödembehandlung eignen sich Lymphdrainagen und lokale Kühlung, möglich auch als „absteigende“ Bäder, wobei es streng genommen für Lymphdrainagen nur eine negative Studie gibt [Uher et al., 2000]. Sobald der Schmerz eine Aktivierung ermöglicht, kann auch mit Traktions- und Mobilisationsbehandlung der betroffenen Gelenke begonnen werden. Später schließen sich Belastungsübungen und im Fall der unteren Extremität entsprechend Gangschulung, evtl. mit Hilfsmitteln, an. Wenn Patienten es sich zutrauen, die erkrankte Extremität trotz Schmerzen selbst zu bewegen, sollten sie dazu in jeder Phase der Erkrankung ermuntert werden.
Bei der „Pain Exposure Physical Therapy“ wird die Physiotherapie (auch passive Verfahren) mit Zustimmung der Patienten unter Ignorieren von Schmerzen durchgeführt. Schmerzen werden im Weiteren auch nicht mehr thematisiert. Diese Herangehensweise führte in einer offenen Studie bei 90% der Patienten zur Verbesserung der Funktion und bei 75% zur Verbesserung der Schmerzen nach 3 Monaten [Ek et al., 2009], Diese Wirkung konnte in einer RCT (primäre ITT- Analyse) allerdings nicht bestätigt werden [Barnhoorn et al., 2015]. Die positiven Effekte der PEPT in der „per protocol“-Analyse sind vorsichtig zu interpretieren, da die zahlreichen schmerzbedingten Studienabbrecher nicht berücksichtigt werden.
Evidenz: Zur Wirksamkeit einer individuell zugeschnittenen Physiotherapie bei CRPS (kürzer als 1 Jahr Dauer) wurden 2 RCTs von der gleichen Arbeitsgruppe durchgeführt [Oerlemans et al., 1999; Oerlemans et al., 2000]. Beide Studien ergaben, dass Physiotherapie sowohl den Schmerz als auch die Funktion positiv beeinflusst. Die Kontrollgruppen wurden mit Ergotherapie (s.u.) bzw. Sozialtherapie behandelt. Die PEPT wirkt nicht auf die CRPS- Schmerzen [Barnhoorn et al., 2015].
Ergotherapie
Wirkungsweise: Die Ergotherapie soll schmerzhafte Bewegungsmuster reduzieren, normale Sensibilität herstellen und Alltagsfunktion gewährleisten. Dazu sollte eine aktive Desensibilisierung der durch Allodynie gekennzeichneten Hautareale mehrmals täglich für kurze Zeit begonnen werden. Ziel ist es, die erkrankte Körperregion wieder an alltägliche Berührung zu gewöhnen. Später erfolgt allmählich ein Wechsel hin zur Einübung schmerzfreier Bewegungen und zum Training der Feinmotorik, zunächst ohne, später gegen Widerstand. Im nächsten Schritt kann, falls nötig auch mittels Hilfsmitteln (Daumenkeile, funktionelle dynamische Schienen), eine allmähliche Stellungskorrektur erfolgen. Die Mitarbeit der Patienten und das ständige Wiederholen der erlernten Übungen sind unerlässlich.
Evidenz: Die beiden Studien zur Wirksamkeit der Physiotherapie untersuchten in parallelen Gruppen auch die Wirksamkeit einer individuellen Ergotherapie [Oerlemans et al., 1999; Oerlemans et al., 2000]. Beide Studien ergaben, dass die Ergotherapie sowohl Schmerz als auch Funktion bei CRPS mit der Dauer < 1 Jahr positiv beeinflusst. Die Wirksamkeit war aber geringer als die der Physiotherapie.
Dosierung: Die Dauer einer Physio- oder Ergotherapie sollte 20–30 Minuten betragen, die Frequenz der Behandlung sollte nach individuellen Bedürfnissen gestaltet werden, in der Regel sind 2–5 Therapieeinheiten/Woche wünschenswert.
Unerwünschte Wirkungen: Wenn durch die Ergotherapie starke Schmerzen und Angst ausgelöst werden, kann sich die Symptomatik aggravieren und sich der Krankheitsverlauf verlängern. Das Auftreten geringerer Schmerzen, was mit den Patienten kommuniziert und von ihnen auch akzeptiert werden muss, ist, um einen Therapiefortschritt zu erzielen, oft nicht zu vermeiden.
Physiotherapie mit verhaltenstherapeutischen Elementen (Spiegeltherapie, „Graded Motor Imagery Program“, „Graded Exposure“)
Empfehlung: Diese Therapieformen sind zu wichtigen Bausteinen der CRPS-Therapie geworden und können vom Patienten auch selbst mit durchgeführt werden. Der Einsatz wird frühzeitig empfohlen.
Aufgrund von Negativergebnissen in einer offenen Multicenterstudie steht das größte Fragezeichen derzeit noch hinter dem „Graded Motor Imagery“, von dem noch nicht klar ist, ob es außerhalb von gut kontrollierten Monocenterstudien wirklich wirksam ist. Der Stellenwert der alleinigen Spiegeltherapie ist aufgrund der kleinen Fallzahlen in den Studien offen.
Wirkungsweise: Diese Therapieformen haben zwei Wirkungsweisen. Zum Ersten normalisieren sie das Zusammenspiel zwischen Sensorik und Motorik auf kortikaler Ebene, und zum Zweiten reduzieren sie die Angst im Umgang mit der schmerzhaften Extremität.
Evidenz: Die Spiegeltherapie als alleinige Therapieform wirkt bei akuten CRPS-Fällen, wie in kleinen kontrollierten Studien gezeigt [McCabe et al., 2003], besonders eindrucksvoll bei CRPS nach Schlaganfall [Cacchio et al., 2009].
Bei chronischen CRPS-Fällen ist das „Graded Motor Imagery“, bestehend aus Links-rechts- Erkennen, Vorstellung von Bewegung und Spiegeltherapie, effektiv. Dies konnte in zwei Einzelautoren-RCTs gezeigt werden [Moseley, 2004, 2006]. Eine nachfolgende offene Multicenterstudie konnte dieses Ergebnis aber nicht bestätigen [Johnson et al., 2012].
Beim Verfahren des „Exposure In Vivo“ (EXP) werden zunächst angstauslösende Situationen (z.B. Schmerzauslösung bei bestimmter Bewegung, Situation, schmerzbezogene Angst) ihrer Hierarchie entsprechend durch einen Psychologen identifiziert und therapiert, und der Patient wird gleichzeitig Schritt für Schritt exponiert (Physiotherapeut). Das EXP wurde zunächst in einer kleinen Fallkontrollstudie auf seine Wirksamkeit untersucht [de Jong et al., 2005]. In einer großen Fallserie bei chronischem CRPS (n = 106) und einer kürzlich erschienenen RCT konnte die Wirksamkeit des Verfahrens, verglichen mit konventioneller rehabilitativer Therapie [den Hollander et al., 2016], eindrucksvoll bestätigt werden. Das EXP reduziert nicht nur Schmerz, es verbessert auch Funktion und Behinderung. Gewisse Schmerzen werden dabei von den Patienten absichtlich in Kauf genommen (no pain, no gain), im Gegensatz zur konventionellen Physiotherapie (no gain with pain).
Dosierung: Die Spiegeltherapie und das Graded Motor Imagery werden nach Instruktionsphasen durch Therapeuten von den Patienten selbst in Einheiten zu je 10 Minuten, wenn möglich, jede wache Stunde des Tages, absolviert. Der gesamte Turnus dauert 6 Wochen. Für das Verfahren des „Graded Exposure“ wird eine kontinuierliche Therapie über 17 Wochen mit 1 h/Woche vorgeschlagen. Heimübungen sind unerlässlich.
Unerwünschte Wirkungen: Keine, allerdings muss die Compliance der Patienten geprüft werden. Vorübergehend kann es zur Schmerzverstärkung kommen.
F 4.6 Psychotherapeutische Verfahren
Empfehlung: Diese Therapieform ist ein wichtiger Baustein in der Therapie des CRPS, vor allem wenn sich psychische Begleiterkrankungen erkennen lassen oder wenn die Symptomatik sich über einen längeren Zeitraum bei überwiegend somatisch orientierter Therapie nicht adäquat bessert [Bean et al., 2016].
Wirkungsweise: Primär dienen sie der angstlösenden Vermittlung eines Modells, um u.a. die psychischen Symptome, die die Patienten bei sich selbst wahrnehmen, besser bewerten zu können. Einige Patienten benötigen Krisenintervention, Entspannungs- und
Imaginationsverfahren. Im Verlauf der Therapie werden Techniken zur Selbstwahrnehmung der körperlichen Belastbarkeit vermittelt, die auch zur Regulation eines angemessenen körperlichen Ent- und Belastungsverhaltens beitragen. Hier haben sich neben Entspannungs- und Biofeedbackverfahren Verhaltensanalysen und -übungen sowie kognitive Interventionen zur Überwindung von Bewegungsangst bewährt. Dies entspricht in weiten Zügen auch der psychologischen Intervention bei EXP (siehe oben).
Patienten, bei denen bereits vor Ausbruch des CRPS eine psychische Störung vorlag, benötigen eine intensivere psychotherapeutische Versorgung. Exzessive Erfahrungen von Kontrollverlust, Hilflosigkeit und Angst, die entweder in der Anamnese [Speck et al., 2017] oder durch das CRPS bzw. durch medizinische und physiotherapeutische Interventionen ausgelöst werden, führen möglicherweise dazu, dass vergessene Reiz-Reaktions-Verbindungen bzw. kognitive und emotionale Schemata reaktiviert werden. In diesen Fällen erlangt die jeweilige psychotherapeutische Behandlung eine Schlüsselstellung für die Gesamttherapie, von der auch der Zeitpunkt für medizinische, insbesondere invasive Interventionen abhängig gemacht werden sollte.
Evidenz: Es gibt zwei kleine Studien mit wenigen Patienten, die die Wirksamkeit einer psychotherapeutischen Intervention bei CRPS, verglichen mit Physiotherapie alleine, nahelegen [Lee et al., 2002; Bruehl & Chung, 2006]. Wahrscheinlich können aber die Ergebnisse einer Vielzahl von Studien zu anderen chronischen Schmerzsyndromen [Turner et al., 2006] auch auf das CRPS übertragen werden.
Unerwünschte Wirkungen: keine. Allerdings kann eine falsche Psychotherapie Symptome verfestigen.
G 4.7 Interventionelle Therapie
Da es in Einzelfällen zu bedrohlichen Komplikationen kommen kann, müssen diese Verfahren hierin ausgebildeten Ärzten vorbehalten sein. Es werden in der Praxis sehr viele unterschiedliche Verfahren angewandt, deshalb wird in dieser Leitlinie nur auf Therapieverfahren eingegangen, für die es eine wissenschaftliche Rationale und positive randomisierte Studien, wie eingangs dieses Kapitels definiert, gibt. Kritisch ist anzumerken, dass die Qualität der klinischen Studien zu diesem Thema insgesamt schlecht ist. So wurde in einer ganz aktuellen Metaanalyse der Cochrane Library zur Wirksamkeit von Sympathikusblockaden [O’Connell et al., 2016] und zu Sympathektomien [Straube et al., 2010] bei neuropathischen Schmerzen und CRPS wieder einmal betont, dass die Datenlage keine Empfehlung zulässt.
Sympathikusblockaden
Wirkungsweise: Im Tierexperiment konnte gezeigt werden, dass unter bestimmten Umständen das sympathische Nervensystem in der Lage ist, Schmerzfasern zu erregen. Bei einer Untergruppe von Patienten mit CRPS verstärkt eine Aktivierung des Sympathikus die Schmerzen und insbesondere die Allodynie [Ali et al., 2000; Baron et al., 2002]. Diese Schmerzen nennt man dann sympathisch unterhalten (sympathetically maintained pain, SMP). Dies hat zu dem Umkehrschluss geführt, dass Blockaden des Sympathikus besonders bei diesen Patienten zur Schmerzreduktion führen sollten. Es gibt leider kein klinisches Symptom, das beim einzelnen Patienten die Beteiligung des Sympathikus an der Schmerzunterhaltung beweist oder ausschließt. Letztlich ist für die Stellung der Diagnose eines SMP nur der analgetische Effekt einer Sympathikusblockade relevant. Bei solchen diagnostischen Sympathikusblockaden sind besonders hohe Anforderungen an den Standard in Durchführung und Bewertung der Effektivität zu stellen. Obwohl es aus theoretischen Überlegungen entscheidend ist, dass eine tatsächliche Ausschaltung der sympathischen Efferenzen zur betroffenen Extremität erfolgt, konnte in einer Studie, die dies näher untersuchte, kein Zusammenhang zwischen der Effizienz der Blockade der Sympathikusfunktion und der Schmerzreduktion gefunden werden [Schurmann et al., 2001], was auf unspezifische Effekte hindeutet. Aufgrund der Invasivität ist eine SMP-Diagnostik erst sinnvoll, wenn medikamentöse und nicht medikamentöse Primärtherapien erfolglos geblieben sind. Auf jeden Fall sind längere Injektionsserien ohne deutliche Besserung sinnlos [Maier & Gleim, 1998].
Grenzstrangblockaden mit Lokalanästhetika (Ganglion stellatum, lumbaler Grenzstrang)
Empfehlung: Der generelle Einsatz von Sympathikusblockaden zur Therapie des CRPS kann aufgrund fehlender Evidenz (negatives Cochrane Review) nicht empfohlen werden. Möglicherweise sind Sympathikusblockaden aber bei positivem Ausfall von Testinjektionen als eine auf maximal einige Wochen begrenzte Behandlungsserie ansonsten therapieresistenter, sympathisch unterhaltener Ruheschmerzen hilfreich. Ihr Einsatz sollte entgegen der derzeitigen Praxis spezialisierten Zentren vorbehalten bleiben.
Evidenz: Es finden sich in der Literatur drei verwertbare RCTs, die Grenzstrangblockaden in ihrer Effektivität auf die Schmerzreduktion bei CRPS untersuchen. In der ersten Studie wurden Stellatumblockaden gegen intravenöse Guanethidinblockaden untersucht. Beides war gleich wirksam (oder unwirksam, siehe oben) [Bonelli et al., 1983]. In der zweiten Studie wurde Lokalanästhetikum gegen Placebo getestet [Price et al., 1998]. Der schmerzlindernde Effekt der Sympathikusblockaden war bezüglich der maximalen analgetischen Wirkung gleich zu Placebo, hielt aber signifikant länger an. Ein potenziell ähnliches Ergebnis zeigte eine kleine Cross-over- RCT mit Botulinumtoxin zur länger dauernden Sympathikusblockade [Carroll et al., 2009]. Allerdings erfüllt diese Studie (n = 7, unvollständiger Ergebnisbericht) nicht die Qualitätsanforderungen für die Bewertung in dieser Leitlinie. In der dritten Studie (RCT) wurden thorakale Sympathikusblockaden gegen Injektionen der gleichen Pharmaka (Lidocain, Dexamethason), aber nicht an den Grenzstrang untersucht [de Oliveira Rocha et al., 2014]. Hier fand sich eine gering bessere Schmerzreduktion durch eine einmalige Sympathikusblockade nach 12 Monaten (aber nicht nach 3 Monaten!). Alle anderen Studien sind unkontrolliert oder retrospektiv, wie in einer umfassenden Metaanalyse verdeutlicht [Cepeda et al., 2002].
Dosierung: Die vorliegenden Studien erlauben keine sicheren Rückschlüsse, ob überhaupt, in welcher Frequenz und wie lange Grenzstrangblockaden angewandt werden sollten. Aufgrund
eigener Erfahrung empfehlen die Autoren zunächst eine Serie von 5 Blockaden in ca. 2 Wochen, bei Erfolg eine Fortsetzung der Serie bis max. 10 Blockaden.
Unerwünschte Wirkungen: Obligat sind ein Horner-Syndrom bei Intervention zur Behandlung der oberen Extremität (Ganglion stellatum) und die Erwärmung der abhängigen Körperpartie. Potenziell sehr gefährlich sind Verletzungen der A. carotis oder der Bauchaorta/Iliacae durch die Injektionen. Durch die invasive Natur können auch der Sympathikus oder andere Teile des Nervensystems selbst geschädigt werden, wodurch die Symptome des CRPS aggraviert werden können.
Rückenmarksnahe Elektrostimulation (SCS = spinal cord stimulation)
Leitlinie herunterladen (PDF-Dokument, 429 kB)
Empfehlung: Die Autoren sehen die Indikation zur SCS derzeit bei sonst therapierefraktären Patienten mit CRPS an der unteren Extremität ohne mechanische Allodynie und ohne gravierende psychische Erkrankung (fachspezifische Untersuchung), bei denen die Probestimulation effektiv war. Für eine breitere Anwendung fehlen die Daten.
Wirkungsweise: Hemmende Systeme sollen durch über den Hintersträngen des Rückenmarks implantierte Elektroden aktiviert werden. Vor einer endgültigen Elektrodenimplantation muss eine Probestimulation mit Erfolgskontrolle erfolgen.
Evidenz: Letztendlich gibt es nur eine RCT, in der Patienten entweder mit SCS und Physiotherapie oder Physiotherapie alleine behandelt wurden [Kemler et al., 2000]. Der analgetische Effekt der SCS in einer hoch selektionierten CRPS-Population, die refraktär auf vorhergehende Behandlungsstrategien war und auf eine Teststimulation reagierte, war positiv. Der Effekt der SCS hielt 2 Jahre an und verminderte sich danach, so dass nach 5 Jahren kein Unterschied mehr nachweisbar war [Kemler et al., 2006, 2008]. Die Kontrollbedingung in dieser Studie (Physiotherapie alleine) war allerdings nicht ideal. Dieselbe Arbeitsgruppe konnte unlängst zeigen, dass eine Allodynie ein negativer Prädiktor der Wirksamkeit einer SCS ist [van Eijs et al., 2010].
Unerwünschte Wirkungen: allgemeines Risiko des Eingriffs, Systemwechseloperation, Systemdislokationen, sekundäre Schädigung anderer Strukturen durch das System.
Elektrische Stimulation von Spinalganglien (DRG-Stimulation)
Empfehlung: Die Ergebnisse der Studie sind sehr interessant, und die DRG-Stimulation kann eine neue Therapieoption bei therapierefraktären CRPS-Fällen der unteren Extremität werden. Aufgrund des zwangsläufig offenen Designs der Studie und damit verbundener methodischer Schwächen sollte eine Bestätigung der Ergebnisse gefordert werden, bevor eine allgemeine Empfehlung ausgesprochen werden kann. Wenn dies der Fall ist, dann kann die DRG- Stimulation für Patienten ohne gravierende psychische Erkrankung (fachspezifische Untersuchung), bei denen die Probestimulation effektiv war (wichtiges Selektionskriterium), eine Therapiealternative zur SCS sein.
Wirkungsweise: An Spinalganglien (DRG) der betroffenen Segmente implantierte Elektroden inhibieren wahrscheinlich sensorische Neurone. Vor einer endgültigen Elektrodenimplantation muss eine Probestimulation mit Erfolgskontrolle erfolgen.
Evidenz: Es gibt aktuell eine offene, aber gut kontrollierte RCT, in der Patienten mit Schmerzen im Rahmen von CRPS I oder II der unteren Extremität (n = 76), die mit 2 Analgetika vorher nicht gebessert werden konnten, mit entweder DRG-Stimulation oder SCS behandelt wurden [Deer et al., 2017]. Der analgetische Effekt der DRG-Stimulation war größer als der der SCS. Über den Zeitraum eines Jahres hatten 70–80% der Patienten eine Schmerzreduktion von > 50% (vgl. zu nur 50–60% in der SCS-Gruppe). Implantiert wurden beide Stimulatoren nur, wenn eine Teststimulation positiv verlief (Selektion). Das war bei 85–90% der Patienten der Fall, der Rest wurde als „Therapieversagen“ gewertet.
Unerwünschte Wirkungen: wie bei SCS: allgemeines Risiko des Eingriffs, Systemwechseloperation, Systemdislokationen, sekundäre Schädigung anderer Strukturen durch das System. Insgesamt war die Komplikationsrate bei DRG-Stimulation tendenziell niedriger als bei SCS, dies gilt vor allem für die Systemdislokation und den damit verbundenen Wirkverlust.
Repetitive transkranielle Magnetstimulation (rTMS) des Motorcortex
Empfehlung: In Einzelfällen kann die rTMS-Therapie bei sonst therapierefraktären Patienten versucht werden, vorzugsweise in klinischen Studien, auf jeden Fall aber in spezialisierten Zentren. Ein großer Nachteil ist die tägliche Anwendung und dass die analgetische Wirkung den Behandlungszeitraum nicht wesentlich überdauert. So müsste eigentlich eine rTMS- Dauertherapie angewandt werden, was für den Routineeinsatz nicht geeignet ist.
Wirkunsgweise: Die rTMS verändert direkt die kortikale Erregbarkeit der stimulierten Hirnareale und bewirkt eine enorme Freisetzung von hemmenden Neurotransmittern. Dadurch wird das Schmerzempfinden reduziert.
Evidenz: Mittlerweile existiertg eine ganze Reihe von kleineren, zum Teil kontrollierten Studien zum Einsatz der rTMS bei therapierefraktären chronischen neuropathischen Schmerzsyndromen wie zentraler Schmerz nach Schlaganfall und Trigeminusneuralgie. Bei therapierefraktärem CRPS gibt es eine RCT mit 23 Teilnehmern, bei der rTMS jeden Tag über 10 Tage angewandt wurde. rTMS wurde mit Schein-rTMS verglichen. rTMS führte während der 10-tägigen Stimulation zu einer signifikanten Schmerzreduktion. 1 Woche nach Beendigung der rTMS war dieser Effekt aber wieder verschwunden [Picarelli et al., 2010]. Daneben existieren Berichte über eine Schmerzreduktion in einer Fallserie [Pleger et al., 2004] und über eine Verbesserung der 2-Punkte-Diskriminationsfähigkeit (David et al., 2015) nach rTMS.
Unerwünschte Wirkungen: Es können epileptische Anfälle getriggert werden. Kontraindikationen sind zu beachten.
Intrathekale Applikation von Wirkstoffen
Die rückenmarksnahe Applikation von Substanzen kann sinnvoll sein, wenn die Blut-Hirn- Schranke nur bei zu hoher oraler Dosis und dem Preis von systemischen Nebenwirkungen ausreichend überwunden wird. Mit Ausnahme von Baclofen gibt es aber für alle anderen dafür in Frage kommenden Substanzen bei CRPS keine gesicherten Daten.
Baclofen
Empfehlung: Wenn schmerzhafte und therapielimitierende dystone Störungen konservativ (Physiotherapie, Botulinumtoxin) nicht beherrschbar sind, ist eine i.th. Baclofentherapie in einem Zentrum, das mit dieser Therapieform Erfahrung hat, gerechtfertigt. Es muss vor einer Dauertherapie eine Probeinjektion erfolgen. Bei Therapieresistenz sollte immer auch an eine psychische Ursache der Bewegungsstörung gedacht werden.
Wirkungsweise: Baclofen ist ein GABA-B-Rezeptor-Agonist, der zur Behandlung motorischer Symptome des CRPS wie Dystonie eingesetzt wird. Aufgrund der Pharmakologie sollte Baclofen aber auch gegen Schmerzen wirksam sein.
Evidenz: Es gibt eine RCT an einer kleinen Zahl von CRPS-Patienten mit Dystonie, bei denen der kontinuierlichen Gabe von Baclofen eine doppelt blinde placebokontrollierte Testinjektion vorausging [van Hilten et al., 2000]. Eine zweite Studie der gleichen Arbeitsgruppe konnte dieses Ergebnis bestätigen [van Rijn et al., 2009]. Die kontinuierliche intrathekale Gabe von Baclofen war über einen Zeitraum von 1,5 Jahren effektiv. Allerdings ist die Komplikationsrate der Pumpentherapie (n = 89 Komplikationen bei 42 Patienten in einem Jahr, Explantation bei 6 Patienten) sehr hoch. Die Selektion der geeigneten Patienten ist schwierig, da bis zu 50% der Patienten unter psychogenen Bewegungsstörungen leiden [Schrag et al., 2004].
Unerwünschte Wirkungen: Liquorunterdrucksyndrom, Gefahr von Infektionen, Benommenheit und Harnverhalt, Systemdefekt.
Plasmapherese
Empfehlung: Die Evidenz zur Wirksamkeit der Plasmapherese ist allenfalls marginal. Die Plasmapherese ist deshalb nicht für die Routineversorgung geeignet und wird nicht empfohlen, solange nicht positive kontrollierte Studien vorliegen.
Wirkweise: Unter der Annahme, dass Autoantikörper in der CRPS-Pathophysiologie eine wichtige Rolle spielen, kann durch Auswaschen dieser Antikörper die Immunantwort moduliert und das CRPS positiv beeinflusst werden.
Evidenz: Es liegen eine positive, aber retrospektive Fallserie mit 33 Patienten (Aradillas et al., 2015) und zwei Fallberichte (Blaes et al., 2014) vor. In den Fallberichten waren die Patienten positiv für Autoantikörper gegen beta2-Adrenorezeptoren. Berichtet wird über eine signifikante Verbesserung von Schmerz und autonomen Symptomen nach der Plasmapherese.
Unerwünschte Wirkungen: katheterassoziierte Infektionen, Gerinnungsstörungen.
H 4.8 Wirkungslose Therapien Kalzitonin
Empfehlung: Aufgrund der uneinheitlichen Studienlage wird Kalzitonin zur Therapie des CRPS nicht empfohlen.
Wirkungsweise: Kalzitonin ist ein Peptidhormon, das in der Schilddrüse gebildet wird (C- Zellen). Es mindert die Osteoklastenaktivität und wirkt auch unabhängig davon analgetisch.
Evidenz: Zur Wirksamkeit von nasal oder per Injektion verabreichtem Lachskalzitonin bei CRPS gibt es 5 Studien, 2 placebokontrollierte RCTs, 3 offene Studien. Die Ergebnisse sind insgesamt uneinheitlich. Während in einer RCT 300 IU nasal verabreichtes Kalzitonin in Ergänzung zur Physiotherapie der Placebogabe vor allem in Bezug auf Schmerz und Erlangung der Arbeitsfähigkeit überlegen war [Gobelet et al., 1992], ließ sich dieses Ergebnis in einer anderen Studie mit 400 IU Kalzitonin nicht reproduzieren [Bickerstaff & Kanis, 1991]. Die offenen Studien waren ebenfalls uneinheitlich, wobei bei offenen Studien ein Negativergebnis [Sahin et al., 2006] höher zu bewerten ist als positive Resultate [Gobelet et al., 1986; Hamamci et al., 1996]. Diese uneinheitliche Studienlage spiegelt sich auch in den unterschiedlichen Bewertungen in den vorliegenden Metaanalysen wider [Kingery, 1997; Perez et al., 2001; Forouzanfar et al., 2002; Wertli et al., 2013; O’Connell et al., 2016].
Dosierung: Es werden 100 IU/Tag Lachskalzitonin als Injektion subkutan verabreicht. Die Dauer der Therapie ist in der Regel 4–8 Wochen.
Unerwünschte Wirkung: Die Hauptnebenwirkung von Kalzitonin ist ein Flush, der mit Blutdruckabfall und Kopfschmerzen einhergehen kann. Langfristige Nebenwirkungen sind bei dieser Dosierung nicht zu erwarten.
i.v. Immunglobuline
Empfehlung: IvIG in der Dosierung 0,5 g/kg sind nicht wirksam und werden nicht empfohlen. Wirkungsweise: Hochdosierte intravenöse Immunglobuline (IvIG) beeinflussen autoimmune
Prozesse und wirken so entzündungshemmend. Die genaue Wirkweise ist noch unklar.
Evidenz: Zur Wirksamkeit von IvIG bei CRPS gibt es eine doppelt blinde RCT mit n = 12 Patienten [Goebel et al., 2010]. In dieser Cross-over-Studie bekamen die Patienten eine einmalige Infusion von 0,5 g/kg IvIG und nach 4 Wochen Placebo oder umgekehrt. In der IvIG- Phase (4 Wochen) waren die Schmerzen und die Funktion mäßig, aber signifikant besser als in der Placebophase. Zwischenzeitlich ist eine große, aktiv placebokontrollierte, doppelt blinde Multicenter-RCT mit 0,5 g/kg IvIG an 111 Patienten durchgeführt worden. Das Ergebnis war in allen Endpunkten negativ [Goebel et al., 2017].
Unerwünschte Wirkungen: Kopfschmerzen, Übelkeit, potenziell allergische Reaktion, Blutdrucksteigerung.
I 4.9 Therapie des CRPS bei Kindern
Empfehlung: Ohne dass ein für solche Störungen kompetenter Pädiater die Behandlung begleitet, sollte eine CRPS-Therapie bei Kindern nicht durchgeführt werden. Darüber hinaus können keine weiteren gesicherten Empfehlungen gegeben werden. Die Autoren vertreten aber nachdrücklich die Meinung, dass aufgrund der prinzipiell guten Prognose bei Kindern irreversible und traumatisierende Maßnahmen gemieden werden sollten.
CRPS bei Kindern ist seltener als bei Erwachsenen und hat eine sehr gute Prognose [Sandroni et al., 2003]. Die bessere Prognose muss auch bei der Therapieplanung berücksichtigt werden, und deshalb sind invasive Maßnahmen fast immer kontraindiziert [Zernikow et al., 2015].
Evidenz: Es gibt keine RCT für die Therapie von CRPS speziell bei Kindern, die strengeren wissenschaftlichen Kriterien standhält. Einige Fallserien berichten über positive Effekte von peripheren Nervenblockaden mit Lokalanästhetika und i.v. Prostacyclinanaloga [Petje et al., 2005], allerdings ohne Kontrolle. Mehrere Berichte finden sich in der Literatur über mögliche positive Effekte von physikalischer Therapie [Wilder et al., 1992], insbesondere in Verbindung mit Verhaltenstherapie [Lee et al., 2002]. Auch diese Arbeiten sind Fallberichte.
Tabelle 1
Therapie des CRPS. Dosisempfehlungen für Erwachsene


5.5 Versorgungskoordination
Ein CRPS kann zunächst ambulant behandelt werden. In die ambulante Behandlung muss aber eine in der Therapie des CRPS erfahrene Institution eingebunden sein. Eine solche Institution können mit der Krankheit erfahrene Kollegen oder Spezial-(Schmerz-)Ambulanzen sein. Eine ambulante Behandlung umfasst neben der medikamentösen auch die Physio-, Ergo- und rehabilitative Therapie sowie die Vorstellung bei den Fachdisziplinen Neurologie, Unfallchirurgie, Anästhesie/Schmerztherapie und Psychosomatik.
Sollte sich im ambulanten Behandlungsprozess eine Stagnation oder gar eine Akzentuierung der Symptome abzeichnen, so sollte schnellstmöglich eine stationäre multimodale Schmerztherapie eingeleitet werden. Diese kann auch in Rahmen einer Rehabehandlung erfolgen. Ein weiterer Grund für die stationäre Behandlung ist Immobilität.
Eine Besonderheit sind die Berufsgenossenschaftlichen Patienten. Solche Patienten sollten bei ausbleibender funktioneller Besserung nicht den „Standardweg“ der EAP (erweiterte ambulante Physiotherapie) gehen, sondern eher im Rahmen einer BGSW stationär behandelt werden, da dann der Schmerzreduktion als Primärziel besser Rechnung getragen werden kann. Die funktionelle Stagnation ohne Schmerz kann dagegen sehr gut ambulant behandelt werden.
6.6 Redaktionskomitee
Federführend
Prof. Dr. Frank Birklein (Sprecher), Universitätsmedizin der Johannes Gutenberg-Universität Mainz, Klinik und Poliklinik für Neurologie, Langenbeckstraße 1, 55131 Mainz
Tel. 06131-173270, Fax 06131-175625, E-Mail: frank.birklein@unimedizin-mainz.de
Fachgebiet Neurologie/Schmerzmedizin
Prof. Dr. Frank Birklein, Universitätsmedizin der Johannes Gutenberg-Universität Mainz, Klinik und Poliklinik für Neurologie, Langenbeckstraße 1, 55131 Mainz
Prof. Dr. Christian Maihöfner, Neurologische Klink, Klinikum Fürth, Jakob-Henle-Straße 1, 90766 Fürth
Prof. Dr. Claudia Sommer, Neurologische Klinik, Universitätsklinikum Würzburg, Josef- Schneider-Straße 11, 97080 Würzburg
Für Österreich: Prof. Dr. Stefan Quasthoff, MedUni Graz, Auenbruggerplatz 22, A-8036 Graz
Für die Schweiz: PD Dr. Andrea Humm, HFR Freiburg – Kantonsspital, Neurologische Abteilung, Medizinische Klinik, Ch de Pensionnats 2-6, CH-1708 Freiburg
Fachgebiet Anästhesie/Schmerzmedizin
Prof. Dr. Christoph Maier, Berufsgenossenschaftliches Universitätsklinikum Bergmannsheil GmbH, Abteilung für Schmerztherapie, Bürkle-de-la-Camp-Platz 1, 44789 Bochum
Fachgebiet Unfallchirurgie/Handchirurgie
Dr. Stefan Middeldorf, Schön Klinik Bad Staffelstein, Orthopädische Klinik, Am Kurpark 11, 96231 Bad Staffelstein
Prof. Dr. Frank Siemers, Direktor der Klinik für Plastische und Handchirurgie/Brandverletztenzentrum, BG Klinikum Bergmannstrost Halle/ Saale, Merseburger Str. 165, 06112 Halle
7.7 Erklärung von Interessen und Umgang mit Interessenkonflikten
Alle Mitwirkenden an der Leitlinie haben ihre Interessenerklärungen (AWMF-Formular zur Erklärung von Interessen im Rahmen von Leitlinienvorhaben) rechtzeitig und vollständig ausgefüllt beim Koordinator bzw. beim Editorial Office Leitlinien der DGN eingereicht. Im Formblatt wurden die Ausfüllenden gebeten, bei den dargelegten Interessen mit anzugeben, ob ein thematischer Bezug zur Leitlinie/zum Leitlinienthema besteht. Bei unvollständigen Angaben wurde Nachbesserung eingefordert. Abgefragt wurde auch die Höhe der Bezüge, die jedoch nicht veröffentlicht wird. Eine Selbsteinschätzung fand nicht mehr statt.
Alle Interessenerklärungen wurden durch einen anonym arbeitenden, unabhängigen und sachkundigen Interessenkonfliktbeauftragten der DGN auf potenzielle thematisch relevante Interessen begutachtet.
Die Angaben wurden im Hinblick auf einen vorliegenden thematischen Bezug, auf thematische Relevanz, Art und Intensität der Beziehung sowie auf die absolute Höhe der Bezüge geprüft.
Folgende Bewertungskriterien wurden zugrunde gelegt:
- bezahlte Gutachter-/Beratertätigkeit für Industrieunternehmen
- Mitarbeit in einem wissenschaftlichen Beirat/Advisory Board: bezahlte Tätigkeit für
- Industrieunternehmen
- Vorträge: bezahlt durch die Industrie
- Autoren- oder Koautorenschaft: nur wenn industriegelenkt
- Forschungsvorhaben/Durchführung klinischer Studien: direkt- oder teilfinanziert von Industrieunternehmen
- Eigentümerinteressen (Patente, Aktienbesitz) mit Leitlinien-Bezug
50-%-Regel der DGN
Eine spezielle Vorgabe der DGN seit Mai 2014 sieht vor, dass für eine ausgewogene Zusammensetzung der Leitliniengruppe mindestens 50 Prozent der an der Leitlinie Beteiligten keine oder nur geringe für die Leitlinie relevante Interessenkonflikte haben dürfen. Die DGN hat sich zur Einführung der 50-%-Regel entschieden, weil damit bei Abstimmungen kein Überhang von Partikularlinteressen entstehen kann.
Bewertungen der dargelegten Interessen
Als potenzieller Interessenkonflikt wurde die Rolle des Leitlinien-Koordinators F. Birklein als Europäischer Koordinator einer zulassungsrelevanten Studie mit Bezug zur Leitlinie bei Grünenthal (Neridronat) gesehen. Innerhalb der Leitlinie wird jedoch keine spezielle Empfehlung zu Neridronat abgegeben, sondern immer auf die Stoffgruppe der Bisphosphonate, die allesamt gleich wirken, insgesamt Bezug genommen. Es ergab sich an der Leitlinien-Mitarbeit keine Konsequenz.
Als weiterer potenzieller Interessenkonflikt wurde bei einem Mitwirkenden (Maier) die Gesamtzahl der Zuwendungen seitens Industrie gesehen, die für sich im geringfügigen Bereich lagen, aber einen Bezug zur Schmerzthematik haben. Herr Maier hat die Leitlinie redigiert, den Inhalt kritisch diskutiert und zum Schluss konsentiert. Die Bemerkungen von Herrn Maier bezogen sich durchweg auf nicht medikamentöse Verfahren und die Wortwahl.
Die 50-%-Regel der DGN wurde eingehalten.
Die dargelegten Interessen der Mitwirkenden und die daraus gezogenen Konsequenzen sind aus Gründen der Transparenz in der tabellarischen Zusammenfassung (siehe Anhang) aufgeführt.
8.8 Finanzierung der Leitlinie
Diese Leitlinie entstand ohne Einflussnahme oder Unterstützung durch die Industrie.
9.9 Methodik der Leitlinienentwicklung
A 9.1 Zusammensetzung der Leitliniengruppe, Beteiligung von Interessengruppen
- Univ.-Prof. Dr. Frank Birklein (Sprecher)
- PD Dr. Andrea Humm, Freiburg, CH
- Prof. Dr. Christoph Maier, Bochum
- Prof. Dr. Christian Maihöfner, Fürth
- Dr. med. Stefan Middeldorf, Bad Staffelstein
- Prof. Dr. Stefan Quasthoff, Graz, A
- Prof. Dr. med. Frank Siemers, Halle
- Prof. Dr. Claudia Sommer, Würzburg
B 9.2 Recherche und Auswahl der wissenschaftlichen Belege
Es erfolgte eine MEDLINE-Recherche der Jahre 2007–2016 mit den Suchkriterien „CRPS, RCT, treatment“ und anschließender Sichtung durch die Autoren.
C 9.3 Verfahren zur Konsensfindung
Nach Überarbeitung des Manuskripts im Umlaufverfahren durch die einzelnen Autoren erfolgte eine Konsensuskonferenz am 12.10.2017 im Rahmen des Dt. Schmerzkongresses. Teilnehmer an dieser Konferenz waren Prof. Dr. Birklein (Neurologie, Deutsche Schmerzgesellschaft), Prof. Dr. Sommer (Neurologie, Deutsche Schmerzgesellschaft), Prof. Dr. Maihöfner (Neurologie, Deutsche Schmerzgesellschaft) und Prof. Dr. Maier (Anästhesie, Deutsche Schmerzgesellschaft).
Diese Leitlinie ist von der Kommission Leitlinien der Deutschen Gesellschaft für Neurologie (DGN) sowie der beteiligten Fachgesellschaften verabschiedet worden.
10.10 Literatur
- Adami S, Fossaluzza V, Gatti D, Fracassi E, Braga V 1997 Bisphosphonate therapy of reflex sympathetic dystrophy syndrome. Ann.Rheum.Dis.; 56: 201-4.
- Ali Z, Raja SN, Wesselmann U, Fuchs PN, Meyer RA, Campbell JN 2000 Intradermal injection of norepinephrine evokes pain in patients with sympathetically maintained pain. Pain; 88: 161-8.
- Aradillas E, Schwartzman RJ, Grothusen JR, Goebel A, Alexander GM 2015 Plasma Exchange Therapy in Patients with Complex Regional Pain Syndrome. Pain Physician; 18: 383-94.
- Barbalinardo S, Loer SA, Goebel A, Perez RS 2016 The Treatment of Longstanding Complex Regional Pain Syndrome with Oral Steroids. Pain Med; 17:337-43.
- Barnhoorn KJ, van de Meent H, van Dongen RT, Klomp FP, Groenewoud H, Samwel H, et al. 2015 Pain exposure physical therapy (PEPT) compared to conventional treatment in complex regional pain syndrome type 1: a randomised controlled trial. BMJ Open; 5: e008283.
- Baron R, Janig W 2004 Complex regional pain syndromes – how do we escape the diagnostic trap? Lancet.; 364: 1739-41.
- Baron R, Schattschneider J, Binder A, Siebrecht D, Wasner G 2002 Relation between sympathetic vasoconstrictor activity and pain and hyperalgesia in complex regional pain syndromes: a case-control study. Lancet; 359: 1655-60.
- Bean DJ, Johnson MH, Heiss-Dunlop W, Kydd RR 2016 Extent of recovery in the first 12 months of complex regional pain syndrome type-1: A prospective study. Eur J Pain; 20: 884-94.
- Bean DJ, Johnson MH, Heiss-Dunlop W, Lee AC, Kydd RR 2015 Do psychological factors influence recovery from complex regional pain syndrome type 1? A prospective study. Pain; 156: 2310-8.
- Beerthuizen A, Stronks DL, Huygen FJ, Passchier J, Klein J, Spijker AV 2011 The association between psychological factors and the development of complex regional pain syndrome type 1 (CRPS1) – A prospective multicenter study. Eur.J.Pain;15:971-5..
- Beerthuizen A, Stronks DL, Spijker Avt, Yaksh A, Hanraets BM, Klein J, et al. 2012 Demographic and medical parameters in the development of complex regional pain syndrome type 1 (CRPS1): prospective study on 596 patients with a fracture. Pain; 153: 1187-92.
- Beerthuizen A, Van’t Spijker A, Huygen FJ, Klein J, de Wit R 2009 Is there an association between psychological factors and the Complex Regional Pain Syndrome type 1 (CRPS1) in adults? A systematic review. Pain; 145: 52-9.
- Beerthuizen A, Stronks DL, Huygen FJPM, Passchier J, Klein J, Van’t Spijker A 2012 The association between psychological factors and the development of complex regional pain syndrome type 1 (CRPS1) – A prospective multicenter study. European Journal of Pain; 15: 971-5.
- Bickerstaff DR, Kanis JA 1991 The use of nasal calcitonin in the treatment of post- traumatic algodystrophy. Br. J Rheumatol.; 30: 291-4.
- Birklein F, Riedl B, Claus D, Neundörfer B 1998 Pattern of autonomic dysfunction in time course of complex regional pain syndrome. Clin.Aut.Res.; 8: 79-85.
- Birklein F, Riedl B, Sieweke N, Weber M, Neundorfer B 2000 Neurological findings in complex regional pain syndromes – analysis of 145 cases. Acta Neurol.Scand.; 101: 262-9.
- Birklein F, Schlereth T 2013 Aktuelles zur Therapie des komplex-regionalen Schmerzsyndroms. Nervenarzt; 84: 1436-44.
- Blaes F, Dharmalingam B, Tschernatsch M, Feustel A, Fritz T, Kohr D, et al. 2015 Improvement of complex regional pain syndrome after plasmapheresis. Eur J Pain; 19:503- 7.
- Bonelli S, Conoscente F, Movilia PG, Restelli L, Francucci B, Grossi E 1983 Regional intravenous guanethidine vs. stellate ganglion block in reflex sympathetic dystrophies: a randomized trial. Pain; 16: 297-307.
- Braus DF, Krauss JK, Strobel J 1994 The shoulder-hand syndrome after stroke: a prospective clinical trial. Ann.Neurol.; 36: 728-33.
- Bruehl S, Chung OY 2006 Psychological and behavioral aspects of complex regional pain syndrome management. Clin.J Pain; 22: 430-7.
- Bruehl S, Maihofner C, Stanton-Hicks M, Perez RS, Vatine JJ, Brunner F, et al. 2016 Complex regional pain syndrome: evidence for warm and cold subtypes in a large prospective clinical sample. Pain; 157: 1674-81.
- Cacchio A, De Blasis E, Necozione S, di Orio F, Santilli V 2009 Mirror therapy for chronic complex regional pain syndrome type 1 and stroke. N.Engl.J Med.; 361: 634-6.
- Carroll I, Clark JD, Mackey S 2009 Sympathetic block with botulinum toxin to treat complex regional pain syndrome. Ann.Neurol.; 65: 348-51.
- Cepeda MS, Lau J, Carr DB 2002 Defining the therapeutic role of local anesthetic sympathetic blockade in complex regional pain syndrome: a narrative and systematic review. Clin.J Pain; 18: 216-33.
- Christensen K, Jensen EM, Noer I 1982 The reflex sympathetic dystrophy syndrome; response to treatment with systemic corticosteroids. Acta.Chir.Scand.; 148: 653-5.
- David M, Dinse HR, Mainka T, Tegenthoff M, Maier C 2015 High-Frequency Repetitive Sensory Stimulation as Intervention to Improve Sensory Loss in Patients with Complex Regional Pain Syndrome I. Front Neurol; 6: 242.
- de Jong JR, Vlaeyen JW, Onghena P, Cuypers C, den Hollander M, Ruijgrok J 2005 Reduction of pain-related fear in complex regional pain syndrome type I: the application of graded exposure in vivo. Pain; 116: 264-75.
- de Mos M, De Bruijn AG, Huygen FJ, Dieleman JP, Stricker BH, Sturkenboom MC 2007 The incidence of complex regional pain syndrome: a population-based study. Pain; 129: 12-20.
- de Oliveira Rocha R, Teixeira MJ, Yeng LT, Cantara MG, Faria VG, Liggieri V, et al. 2014 Thoracic sympathetic block for the treatment of complex regional pain syndrome type I: A double-blind randomized controlled study. Pain; 155: 2274-81.
- Decramer M, Rutten-van Molken M, Dekhuijzen PN, Troosters T, van Herwaarden C, Pellegrino R, et al. 2005 Effects of N-acetylcysteine on outcomes in chronic obstructive pulmonary disease (Bronchitis Randomized on NAC Cost-Utility Study, BRONCUS): a randomised placebo-controlled trial. Lancet; 365: 1552-60.
- Deer TR, Levy RM, Kramer J, Poree L, Amirdelfan K, Grigsby E, et al. 2017 Dorsal root ganglion stimulation yielded higher treatment success rate for complex regional pain syndrome and causalgia at 3 and 12 months: a randomized comparative trial. Pain; 158: 669-81.
- den Hollander M, Goossens M, de Jong J, Ruijgrok J, Oosterhof J, Onghena P, et al. 2016 Expose or protect? A randomized controlled trial of exposure in vivo vs pain-contingent treatment as usual in patients with complex regional pain syndrome type 1. Pain; 157: 2318-29.
- Dilek B, Yemez B, Kizil R, Kartal E, Gulbahar S, Sari O, et al. 2012 Anxious personality is a risk factor for developing complex regional pain syndrome type I. Rheumatology International; 32: 915-20.
- Ek JW, van Gijn JC, Samwel H, van Egmond J, Klomp FP, van Dongen RT 2009 Pain exposure physical therapy may be a safe and effective treatment for longstanding complex regional pain syndrome type 1: a case series. Clin.Rehabil.; 23: 1059-66.
- Forouzanfar T, Koke AJ, van Kleef M, Weber WE 2002 Treatment of complex regional pain syndrome type I. Eur J Pain; 6: 105-22.
- Frettloh J, Huppe M, Maier C. Das komplexe regionale Schmerzsyndrom (M. Sudeck, Kausalgie). In: Basler F, Kröner-Herwig B, Rehfisch HP, editors. Psychologische Schmerztherapie. Heidelberg: Springer; 2003. p. 467-88.
- Frettloh J, Huppe M, Maier C 2006 Severity and specificity of neglect-like symptoms in patients with complex regional pain syndrome (CRPS) compared to chronic limb pain of other origins. Pain; 124: 184-9.
- Geertzen JH, de-Bruijn-Kofman AT, de-Bruijn HP, van-de-Wiel HB, Dijkstra PU 1998 Stressful life events and psychological dysfunction in Complex Regional Pain Syndrome type I. Clin.J.Pain; 14: 143-7.
- Gierthmuhlen J, Maier C, Baron R, Tolle T, Treede RD, Birbaumer N, et al. 2012 Sensory signs in complex regional pain syndrome and peripheral nerve injury. Pain; 153: 765-74.
- Gobelet C, Meier JL, Schaffner W, Bischof-Delaloye A, Gerster JC, Burckhardt P 1986 Calcitonin and reflex sympathetic dystrophy syndrome. Clin.Rheumatol.; 5: 382-8.
- Gobelet C, Waldburger M, Meier JL 1992 The effect of adding calcitonin to physical treatment on reflex sympathetic dystrophy. Pain; 48: 171-5.
- Goebel A, Baranowski A, Maurer K, Ghiai A, McCabe C, Ambler G 2010 Intravenous immunoglobulin treatment of the complex regional pain syndrome: a randomized trial. Ann.Intern.Med.; 152: 152-8.
- Goebel A, Bisla J, Carganillo R, Frank B, Gupta R, Kelly J, et al. 2017 Low-Dose Intravenous Immunoglobulin Treatment for Long-Standing Complex Regional Pain Syndrome: A Randomized Trial. Ann Intern Med; 167: 476-83.
- Gradl G, Steinborn M, Wizgall I, Mittlmeier T, Schurmann M 2003 Das akute CRPS I (Morbus Sudeck) nach distaler Radiusfraktur – Methoden der Frühdiagnostik. Zentralbl.Chir; 128: 1020-6.
- Graif M, Schweitzer ME, Marks B, Matteucci T, Mandel S 1998 Synovial effusion in reflex sympathetic dystrophy: an additional sign for diagnosis and staging. Skeletal.Radiol.; 27: 262-5.
- Grundberg AB 1996 Reflex sympathetic dystrophy: treatment with long-acting intramuscular corticosteroids. J.Hand Surg.Am.; 21: 667-70.
- Gustin SM, Schwarz A, Birbaumer N, Sines N, Schmidt AC, Veit R, et al. 2010 NMDA- receptor antagonist and morphine decrease CRPS-pain and cerebral pain representation. Pain; 151: 69-76.
- Hamamci N, Dursun E, Ural C, Cakci A 1996 Calcitonin treatment in reflex sympathetic dystrophy: a preliminary study. Br.J Clin.Pract.; 50: 373-5.
- Harden RN, Bruehl S, Perez RS, Birklein F, Marinus J, Maihofner C, et al. 2010a Validation of proposed diagnostic criteria (the „Budapest Criteria“) for Complex Regional Pain Syndrome. Pain; 150: 268-74.
- Harden RN, Bruehl S, Perez RS, Birklein F, Marinus J, Maihofner C, et al. 2010b Development of a severity score for CRPS. Pain; 151: 870-6.
- Harden RN, Maihofner C, Abousaad E, Vatine JJ, Kirsling A, Perez R, et al. 2017 A prospective, multisite, international validation of the Complex Regional Pain Syndrome Severity Score. Pain; 158: 1430-6.
- Johnson S, Hall JA, Barnett S, Draper M, Darbyshire G, Haynes L, et al. 2012 Using graded motor imagery for complex regional pain syndrome in clinical practice: Failure to improve pain. Eur J Pain; in press.
- Kalita J, Vajpayee A, Misra UK 2006 Comparison of prednisolone with piroxicam in complex regional pain syndrome following stroke: a randomized controlled trial. QJM.; 99: 89-95.
- Kemler MA, Barendse GA, van Kleef M, de Vet HC, Rijks CP, Furnee CA, et al. 2000 Spinal cord stimulation in patients with chronic reflex sympathetic dystrophy. N.Engl.J Med.; 343: 618-24.
- Kemler MA, de Vet HC, Barendse GA, van den Wildenberg FA, van Kleef M 2006 Spinal cord stimulation for chronic reflex sympathetic dystrophy – five-year follow-up. N.Engl.J Med.; 354: 2394-6.
- Kemler MA, de Vet HC, Barendse GA, van den Wildenberg FA, van Kleef M 2008 Effect of spinal cord stimulation for chronic complex regional pain syndrome Type I: five-year final follow-up of patients in a randomized controlled trial. J.Neurosurg.; 108: 292-8.
- Kim M, Cho S, Lee JH 2016 The Effects of Long-Term Ketamine Treatment on Cognitive Function in Complex Regional Pain Syndrome: A Preliminary Study. Pain Med; 17: 1447-51.
- Kingery WS 1997 A critical review of controlled clinical trials for peripheral neuropathic pain and complex regional pain syndromes. Pain; 73: 123-39.
- Kolb L, Lang C, Seifert F, Maihofner C 2012 Cognitive correlates of „neglect-like syndrome“ in patients with complex regional pain syndrome. Pain; 153: 1063-73.
- Kozin F, Ryan LM, Carerra GF, Soin JS, Wortmann RL 1981 The reflex sympathetic dystrophy syndrome (RSDS). III. Scintigraphic studies, further evidence for the therapeutic efficacy of systemic corticosteroids, and proposed diagnostic criteria. Am.J Med.; 70: 23- 30.
- Kramer HH, Hofbauer LC, Szalay G, Breimhorst M, Eberle T, Zieschang K, et al. 2014 Osteoprotegerin: a new biomarker for impaired bone metabolism in complex regional pain syndrome? Pain; 155: 889-95.
- Krumova EK, Frettloh J, Klauenberg S, Richter H, Wasner G, Maier C 2008 Long-term skin temperature measurements – a practical diagnostic tool in complex regional pain syndrome. Pain; 140: 8-22.
- Lee BH, Scharff L, Sethna NF, McCarthy CF, Scott-Sutherland J, Shea AM, et al. 2002 Physical therapy and cognitive-behavioral treatment for complex regional pain syndromes. J Pediatr.; 141: 135-40.
- Lewis JS, Kersten P, McPherson KM, Taylor GJ, Harris N, McCabe CS, et al. 2010 Wherever is my arm? Impaired upper limb position accuracy in complex regional pain syndrome. Pain; 149: 463-9.
- Maier C, Baron R. Neuropathische Schmerzen. In: Diener HC, Maier C, editors. Das Schmerztherapiebuch. 2 ed. München: Urban und Fischer; 2003. p. 124-96.
- Maier C, Gleim M 1998 Diagnostik und Therapie des sympathisch unterhaltenen Schmerzes. Schmerz.; 12: 282-303.
- Mainka T, Bischoff FS, Baron R, Krumova EK, Nicolas V, Pennekamp W, et al. 2014 Comparison of muscle and joint pressure-pain thresholds in patients with complex regional pain syndrome and upper limb pain of other origin. Pain; 155: 591-7.
- Manicourt DH, Brasseur JP, Boutsen Y, Depreseux G, Devogelaer JP 2004 Role of alendronate in therapy for posttraumatic complex regional pain syndrome type I of the lower extremity. Arthritis.Rheum.; 50: 3690-7.
- McCabe CS, Haigh RC, Ring EF, Halligan PW, Wall PD, Blake DR 2003 A controlled pilot study of the utility of mirror visual feedback in the treatment of complex regional pain syndrome (type 1). Rheumatology (Oxford); 42: 97-101.
- Moseley GL 2004 Graded motor imagery is effective for long-standing complex regional pain syndrome: a randomised controlled trial. Pain; 108: 192-8.
- Moseley GL 2006 Graded motor imagery for pathologic pain: a randomized controlled trial. Neurology; 67: 2129-34.
- Moseley GL, Herbert RD, Parsons T, Lucas S, Van Hilten JJ, Marinus J 2014 Intense pain soon after wrist fracture strongly predicts who will develop complex regional pain syndrome: prospective cohort study. J Pain; 15: 16-23.
- Noppers IM, Niesters M, Aarts LP, Bauer MC, Drewes AM, Dahan A, et al. 2011 Drug- induced liver injury following a repeated course of ketamine treatment for chronic pain in CRPS type 1 patients: A report of 3 cases. Pain; 152:2173-8.
- O’Connell NE, Wand BM, Gibson W, Carr DB, Birklein F, Stanton TR 2016 Local anaesthetic sympathetic blockade for complex regional pain syndrome. Cochrane Database Syst Rev; 7: CD004598.
- O’Connell NE, Wand BM, McAuley J, Marston L, Moseley GL 2013 Interventions for treating pain and disability in adults with complex regional pain syndrome. Cochrane.Database.Syst.Rev.; 4: CD009416.
- Oaklander AL, Rissmiller JG, Gelman LB, Zheng L, Chang Y, Gott R 2006 Evidence of focal small-fiber axonal degeneration in complex regional pain syndrome-I (reflex sympathetic dystrophy). Pain; 120: 235-43.
- Oerlemans HM, Oostendorp RA, de Boo T, Goris RJ 1999 Pain and reduced mobility in complex regional pain syndrome I: outcome of a prospective randomised controlled clinical trial of adjuvant physical therapy versus occupational therapy. Pain; 83: 77-83.
- Oerlemans HM, Oostendorp RA, de Boo T, van der LL, Severens JL, Goris JA 2000 Adjuvant physical therapy versus occupational therapy in patients with reflex sympathetic dystrophy/complex regional pain syndrome type I. Arch.Phys.Med.Rehabil.; 81: 49-56.
- Perez RS, Kwakkel G, Zuurmond WW, de Lange JJ 2001 Treatment of reflex sympathetic dystrophy (CRPS type 1): a research synthesis of 21 randomized clinical trials. J Pain Symptom.Manage.; 21: 511-26.
- Perez RS, Pragt E, Geurts J, Zuurmond WW, Patijn J, van Kleef M 2008 Treatment of patients with complex regional pain syndrome type I with mannitol: a prospective, randomized, placebo-controlled, double-blinded study. J.Pain; 9: 678-86.
- Perez RS, Zuurmond WW, Bezemer PD, Kuik DJ, van loenen AC, de Lange JJ, et al. 2003 The treatment of complex regional pain syndrome type I with free radical scavengers: a randomized controlled study. Pain; 102: 297-307.
- Petje G, Radler C, Aigner N, Walik N, Kriegs AG, Grill F 2005 Treatment of reflex sympathetic dystrophy in children using a prostacyclin analog: preliminary results. Clin.Orthop.Relat Res.: 178-82.
- Picarelli H, Teixeira MJ, de Andrade DC, Myczkowski ML, Luvisotto TB, Yeng LT, et al. 2010 Repetitive transcranial magnetic stimulation is efficacious as an add-on to pharmacological therapy in complex regional pain syndrome (CRPS) type I. J.Pain; 11: 1203-10.
- Pleger B, Janssen F, Schwenkreis P, Volker B, Maier C, Tegenthoff M 2004 Repetitive transcranial magnetic stimulation of the motor cortex attenuates pain perception in complex regional pain syndrome type I. Neurosci.Lett.; 356: 87-90.
- Price DD, Long S, Wilsey B, Rafii A 1998 Analysis of peak magnitude and duration of analgesia produced by local anesthetics injected into sympathetic ganglia of complex regional pain syndrome patients. Clin.J.Pain; 14: 216-26.
- Reinersmann A, Haarmeyer GS, Blankenburg M, Frettloh J, Krumova EK, Ocklenburg S, et al. 2010 Left is where the L is right. Significantly delayed reaction time in limb laterality recognition in both CRPS and phantom limb pain patients. Neurosci.Lett.; 486: 240-5.
- Reinersmann A, Landwehrt J, Krumova EK, Ocklenburg S, Gunturkun O, Maier C 2012 Impaired spatial body representation in complex regional pain syndrome type 1 (CRPS I). Pain; 153: 2174-81.
- Robinson JN, Sandom J, Chapman PT 2004 Efficacy of pamidronate in complex regional pain syndrome type I. Pain Med.; 5: 276-80.
- Sahin F, Yilmaz F, Kotevoglu N, Kuran B 2006 Efficacy of salmon calcitonin in complex regional pain syndrome (type 1) in addition to physical therapy. Clin.Rheumatol.; 25: 143- 8.
- Sandroni P, Benrud-Larson LM, McClelland RL, Low PA 2003 Complex regional pain syndrome type I: incidence and prevalence in Olmsted county, a population-based study. Pain; 103: 199-207.
- Schilder JC, Sigtermans MJ, Schouten AC, Putter H, Dahan A, Noldus LP, et al. 2013 Pain relief is associated with improvement in motor function in complex regional pain syndrome type 1: secondary analysis of a placebo-controlled study on the effects of ketamine. J Pain; 14: 1514-21.
- Schrag A, Trimble M, Quinn N, Bhatia K 2004 The syndrome of fixed dystonia: an evaluation of 103 patients. Brain.; 127: 2360-72.
- Schurmann M, Gradl G, Wizgal I, Tutic M, Moser C, Azad S, et al. 2001 Clinical and physiologic evaluation of stellate ganglion blockade for complex regional pain syndrome type I. Clin.J Pain; 17: 94-100.
- Schurmann M, Zaspel J, Lohr P, Wizgall I, Tutic M, Manthey N, et al. 2007 Imaging in early posttraumatic complex regional pain syndrome: a comparison of diagnostic methods. Clin J Pain; 23: 449-57.
- Schwartzman RJ, Alexander GM, Grothusen JR, Paylor T, Reichenberger E, Perreault M 2009 Outpatient intravenous ketamine for the treatment of complex regional pain syndrome: A double-blind placebo controlled study. Pain; 147: 107-15.
- Sigtermans MJ, van Hilten JJ, Bauer MC, Sesmu AM, Marinus J, Sarton EY, et al. 2009 Ketamine produces effective and long-term pain relief in patients with Complex Regional Pain Syndrome Type 1. Pain;145:304-11
- Singh G, Willen SN, Boswell MV, Janata JW, Chelimsky TC 2004 The value of interdisciplinary pain management in complex regional pain syndrome type I: a prospective outcome study. Pain Physician; 7: 203-9.
- Speck V, Schlereth T, Birklein F, Maihofner C 2017 Increased prevalence of posttraumatic stress disorder in CRPS. Eur J Pain; 21: 466-73.
- Stanton-Hicks M, Jänig W, Hassenbusch S, Haddox JD, Boas RA, Wilson PR 1995 Reflex sympathetic dystrophy: changing concepts and taxonomy. Pain; 63: 127-33.
- Straube S, Derry S, Moore RA, McQuay HJ 2010 Cervico-thoracic or lumbar sympathectomy for neuropathic pain and complex regional pain syndrome. Cochrane.Database.Syst.Rev.: CD002918.
- Tan EC, Tacken MC, Groenewoud JM, van Goor H, Frolke JP 2010 Mannitol as salvage treatment for Complex Regional Pain Syndrome Type I. Injury; 41: 773-7.
- Taskaynatan MA, Ozgul A, Tan AK, Dincer K, Kalyon TA 2004 Bier block with methylprednisolone and lidocaine in CRPS type I: a randomized, double-blinded, placebo- controlled study. Reg Anesth.Pain Med.; 29: 408-12.
- Turner JA, Mancl L, Aaron LA 2006 Short- and long-term efficacy of brief cognitive- behavioral therapy for patients with chronic temporomandibular disorder pain: a randomized, controlled trial. Pain; 121: 181-94.
- Uher EM, Vacariu G, Schneider B, Fialka V 2000 Manuelle Lymphdrainage im Vergleich zur Physiotherapie bei Complex Regional Pain Syndrom Typ I. Randomisierte kontrollierte Therapievergleichsstudie. Wien Klin Wochenschr; 112: 133-7.
- van de Vusse AC, Stomp-van den Berg SG, Kessels AH, Weber WE 2004 Randomised controlled trial of gabapentin in Complex Regional Pain Syndrome type 1. BMC.Neurol; 4: 13.
- van Eijs F, Smits H, Geurts JW, Kessels AG, Kemler MA, van Kleef M, et al. 2010 Brush- evoked allodynia predicts outcome of spinal cord stimulation in complex regional pain syndrome type 1. Eur.J.Pain; 14: 164-9.
- van Hilten BJ, van de Beek WJ, Hoff JI, Voormolen JH, Delhaas EM 2000 Intrathecal baclofen for the treatment of dystonia in patients with reflex sympathetic dystrophy. N.Engl.J Med.; 343: 625-30.
- van Rijn MA, Munts AG, Marinus J, Voormolen JH, de Boer KS, Teepe-Twiss IM, et al. 2009 Intrathecal baclofen for dystonia of complex regional pain syndrome. Pain; 143: 41-7.
- Vaneker M, Wilder-Smith OH, Schrombges P, Man-Hermsen I, Oerlemans HM 2005 Patients initially diagnosed as „warm“ or „cold“ CRPS 1 show differences in central sensory processing some eight years after diagnosis: a quantitative sensory testing study. Pain; 115: 204-11.
- Varenna M, Adami S, Rossini M, Gatti D, Idolazzi L, Zucchi F, et al. 2013 Treatment of complex regional pain syndrome type I with neridronate: a randomized, double-blind, placebo-controlled study. Rheumatology (Oxford); 52: 534-42.
- Varenna M, Zucchi F, Ghiringhelli D, Binelli L, Bevilacqua M, Bettica P, et al. 2000 Intravenous clodronate in the treatment of reflex sympathetic dystrophy syndrome. A randomized, double blind, placebo controlled study. J Rheumatol.; 27: 1477-83.
- Veldman PHJM, Reynen HM, Arntz IE, Goris RJA 1993 Signs and symptoms of reflex sympathetic dystrophy: prospective study of 829 patients. Lancet; 342: 1012-6.
- Wasner G, Schattschneider J, Baron R 2002 Skin temperature side differences – a diagnostic tool for CRPS? Pain; 98: 19-26.
- Wertli M, Bachmann L, Weiner S, Brunner F 2013 Prognostic factors in complex regional pain syndrome 1: A systematic review. Journal of rehabilitation medicine: official journal of the UEMS European Board of Physical and Rehabilitation Medicine; 45: 225-31.
- Wilder RT, Berde CB, Wolohan M, Vieyra MA, Masek BJ, Micheli LJ 1992 Reflex sympathetic dystrophy in children. Clinical characteristics and follow-up of seventy patients. J Bone Joint Surg.Am.; 74: 910-9.
- Wuppenhorst N, Maier C, Frettloh J, Pennekamp W, Nicolas V 2010 Sensitivity and specificity of 3-phase bone scintigraphy in the diagnosis of complex regional pain syndrome of the upper extremity. Clin.J.Pain; 26: 182-9.
- Zernikow B, Wager J, Brehmer H, Hirschfeld G, Maier C 2015 Invasive treatments for complex regional pain syndrome in children and adolescents: a scoping review. Anesthesiology; 122: 699-707.
- Zuurmond WW, Langendijk PN, Bezemer PD, Brink HE, de Lange JJ, van loenen AC 1996 Treatment of acute reflex sympathetic dystrophy with DMSO 50% in a fatty cream. Acta Anaesthesiol.Scand.; 40: 364-7.
11.11 Anhang
A 11.1 Erklärung von Interessen: tabellarische Zusammenfassung
Die Originale der vollständig ausgefüllten Interessenerklärungen sind beim Leitlinienkoordinator/Editorial Office Leitlinien (EO) hinterlegt. Aus Transparenzgründen werden alle potenziellen Interessen, auch wenn sie keinen thematischen Bezug zur Leitlinie besitzen, dargelegt. Liegt ein Bezug zur Leitlinie oder thematische Relevanz vor, wird dies erwähnt. Das abschließende Ergebnis der Bewertungen durch einen Interessenkonfliktbeauftragten der DGN und der Leitliniengruppe ist angegeben.





Impressum
© 2018 Deutsche Gesellschaft für Neurologie, Reinhardstr. 27 C, 10117 Berlin
Kommission Leitlinien der DGN
Vorsitzende
Prof. Dr. med. Hans-Christoph Diener
Prof. Dr. med. Christian Gerloff (stellv.)
Redaktionsleitung
Prof. Dr. med. Christian Weimar
Mitglieder (alphabetisch)
Prof. Dr. med. Peter Berlit (Vertreter der Chefärzte), Prof. Dr. med. Claudio L.A. Bassetti (Vertreter der SNG), Dr. med. Uwe Meier (Vertreter der Niedergelassenen), Prof. Dr. med. Jörg R. Weber (Vertreter der ÖGN), Prof. Dr. med. Claudia Sommer (Vertreterin für Schmerzen und PNP), Prof. Dr. med. Dr. h.c. Günther Deuschl, PD Dr. med. Karla Eggert, Prof. Dr. med. Christian Elger, Prof. Dr. med. Gereon R. Fink, Prof. Dr. med. Peter U. Heuschmann, Prof. Dr. med. Andreas Hufschmidt, Prof. Dr. med. Thomas Lempert, Prof. Dr. med. Dr. h.c. Wolfgang H. Oertel, Prof. Dr. med. Hans-Walter Pfister, Prof. Dr. med. Heinz Reichmann, PD Dr. Christiane Schneider-Gold, Prof. Dr. med. Bernhard J. Steinhoff, Prof. Dr. med. Lars Timmermann, Prof. Dr. med. Claus W. Wallesch, Prof. Dr. med. Christian Weimar, Prof. Dr. med. Michael Weller, Prof. Dr. med. Wolfgang Wick
Editorial Office der DGN
Leitlinienbeauftragter der DGN: Christian Weimar, Essen
Redaktion: Frank Miltner, Katja Ziegler, Sonja van Eys, albertZWEI media GmbH, Oettingenstr. 25, 80538 München
Clinical Pathways: Priv.-Doz. Dr. med. Andreas Hufschmidt
Kontakt: leitlinien@dgn.org
Schnellnavigation: Hier geht es weiter zu McGill Schmerzskala


